
| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
分析 由稀释规律知,1份pH=1的盐酸升高pH=2时所加水应该约为9份;设加NaOH溶液x份,则盐酸与NaOH溶液(据题意知其浓度应为0.1 mol•L-1)反应后仍有盐酸剩余,即得加入的水与NaOH溶液的体积比.
解答 解:将pH=l的盐酸加适量的水,pH升高了1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍;
另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1,
可设碱液体积x,盐酸的体积为1L,
依题意可列出下列等式:10-1×1-10-1•x=10-2(1+x),解之得x=$\frac{9}{11}$,则加入的水与NaOH溶液的体积比为9:$\frac{9}{11}$=11:1,
故选B.
点评 本题是关于pH的计算,综合性强,涉及溶液的稀释和酸碱中和后混合液的pH计算,具有一定的难度,解题的关键是概念清楚,公式准确,根据题意求解,关于pH的计算,在熟练掌握基础知识的同时,还应根据题目的要求,灵活运用,解决实际问题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)>c(CH3COO-)+c(OH-) | ||
| C. | c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠可用作调味剂 | |
| B. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾可用作净水剂 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)=CO2(g)△H=+110.5 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以甲醇为原料,以KOH为电解质溶液的可充电的高效燃料电池,其电化学过程如图.
以甲醇为原料,以KOH为电解质溶液的可充电的高效燃料电池,其电化学过程如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
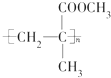 .下列关于它的叙述中不正确的是( )
.下列关于它的叙述中不正确的是( )| A. | 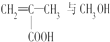 在一定条件下发生缩聚反应即可合成该有机玻璃 在一定条件下发生缩聚反应即可合成该有机玻璃 | |
| B. | 该有机玻璃能发生氧化反应 | |
| C. | 合成该有机玻璃的原料可能有甲烷 | |
| D. | 它在一定条件下发生水解反应时C-O键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
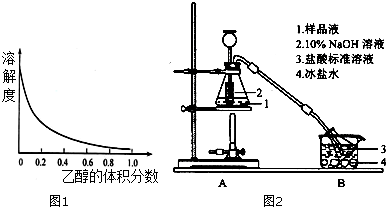
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com