
分析 (1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较PH,再按照溶液的PH由大到小进行排序;
(2)C(H+)•C(OH-)=Kw,纯水溶液中氢离子浓度始终等于氢氧根离子浓度,温度不变,水的离子积常数不变.
在室温时,纯水的电离度为α1,水电离出的c(H+)=c(OH-)=1×10-7mol•L-1;
pH=x的盐酸中C(H+)=10-xmol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,求得水电离出的C(H+)=C(OH-)=10x-14mol/L,水的电离度为α2;
pH=y的氨水溶液中C(H+)=10-ymol/L,x+y=14,则水电离出的C(H+)=C(OH-)=10x-14mol/L,水的电离度为α3;
pH=x的盐酸和pH=y的氨水等体积混合,氨水过量,显碱性,但是碱性小于原来氨水溶液,所得溶液中水的电离度为α4,据此分析解答;
(3)体积相同的盐酸、硫酸、醋酸中和碱的能力相同,则三种酸中氢离子的总浓度相同,由于醋酸部分电离,其氢离子浓度较小,盐酸与硫酸中氢离子浓度相同;
(4)酸的电离常数越大,酸的酸性越强,结合强酸制弱酸的原理分析.
解答 解:(1)属于碱的为:④Ba(OH)2⑤NaOH,浓度相同时,碱性④>⑤;
水解呈碱性的为:⑥CH3COONa,但水解程度较小,则pH:④>⑤>⑥;
溶液呈中性的为:⑦KCl;
溶液呈酸性的有:①②③⑧,其中①为一元强酸,②为二元强酸,③为弱酸,⑧水解呈酸性,浓度相同时,
溶液的pH:②<①<③<⑧,
综合以上分析可知,溶液的pH由小到大的顺序是为:②①③⑧⑦⑥⑤④,
故答案为:②①③⑧⑦⑥⑤④.
(2)在室温时,纯水中H2O?H++OH-,Kw=C(H+)•C(OH-)=10-14,所以水电离出的c(H+)=c(OH-)=1×10-7mol•L-1,纯水的电离度为α1;酸碱抑制水的电离,水解的盐促进水的电离;
pH=x的盐酸中C(H+)=10-xmol/L,水的电离,根据Kw=C(H+)•C(OH-)=10-14,求得水电离出的C(H+)=C(OH-)=10x-14mol/L,水的电离度为α2,酸抑制水的电离,则α2<α1;
pH=y的氨水溶液中C(H+)=10-ymol/L,x+y=14,则水电离出的C(H+)=C(OH-)=10x-14mol/L,水的电离度为α3,则α3=α2;
盐酸为强电解质,pH=x的盐酸和pH=y的氨水按等体积混合,反应后氨水过量,显碱性,但是碱性小于原来氨水溶液,对水的电离的抑制程度较原来氨水溶液小,则α4>α3,而且α1>α4,所以α3=α2<α4<α1;
故答案为:α3=α2<α4<α1;
(3)体积相同的盐酸、硫酸、醋酸中和碱的能力相同,则三种酸中氢离子的总浓度相同,由于醋酸部分电离,其氢离子浓度较小,盐酸与硫酸中氢离子浓度相同,即氢离子浓度:硫酸=盐酸>醋酸,所以pH:Z>X=Y;
故答案为:Z>X=Y;
(4)酸的电离常数越大,酸的酸性越强,已知电离常数:Ky1>Kx>Ky2>Kz,则酸性:H2Y>HX>HY->HZ,
由强酸制弱酸原理可知:NaX+H2Y=NaHY+HX,NaZ+NaHY=Na2Y+HZ;
故答案为:NaHY+HX;Na2Y+HZ.
点评 本题考查了弱电解质的电离、盐类的水解、强酸制弱酸原理等知识点,试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 分别加水稀释10倍,两溶液的pH仍相等 | |
| B. | 温度升高10℃,两溶液的pH均不变 | |
| C. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| D. | 用相同浓度的盐酸中和至反应完全时,消耗盐酸的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H原子形成1 mol H-H键要吸收热量 | |
| B. | 所有燃烧反应都是放热反应 | |
| C. | 在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 | |
| D. | 在一定条件下,1mol H2 与足量的Cl2、Br2、I2 分别反应,放出热量关系是I2>Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
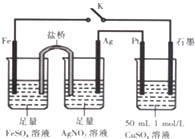
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 导线中流过0.2mol电子时,加入4.9gCu(OH)2,CuSO4溶液可恢复原组成 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 闭合K,外电路电流方向为Fe电极→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 溶液的H+浓度变化:①增大,②减小 | |
| D. | 电极反应式①中阳极:4OH--4e-═2H2O+O2↑,②中负极:2H++2e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com