
科目:高中化学 来源: 题型:
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g) 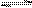 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol·L-1 | 0.08 | a | b |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强, v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y) = 0.03 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种主族元素,已知X+和Y-具有相同电子层结构,Z元素原子核电荷数比Y元素原子核电荷数少9,Y-在一定条件下可被氧化成YZ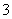 ,则下列说法正确的是
,则下列说法正确的是
A.X、Y、Z均属于短周期元素 B.离子半径X+>Y-
C.Y的气态氢化物可形成氢键
D.X、Y、Z三种元素组成的化合物中既含有离子键又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中离子一定能够大量共存的是( )
A. 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+
B. 能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、S2-、SO32-
C. c(H+)∶c(OH-)=1∶1012的水溶液中:CO32-、Na+、NO3-、AlO2-
D. 无色溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子。
(1)C的元素符号是 ;元素F在周期表中的位置 。
 (2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(3)C4气态分子结构如图所示,已知断裂1molC-C吸收l67KJ的热量,
生成lmol C C放出942KJ热量。试写出由C4气态分子变成C2气态分
C放出942KJ热量。试写出由C4气态分子变成C2气态分
子的热化学方程式 。
(4)某盐x (C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分
步水解而呈弱酸性。
① 盐x显酸性原因(用离子方程式表示) 。
② 写出足量金属镁加入盐x的溶液中所发生反应的化学方程式
。
(5)E所在周期中原子半径最大的元素与D元素可形成化合物у,酚酞试液遇у先变红后褪色,写出等物质的量的у与FeSO4投入水中恰好完全反应的离子反应方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭绝热容器中,发生放热反应:SO2(g)+NO2(g)SO3(g)+NO(g),下列有关说法正确的是
A.反应达到平衡时,降低温度,平衡逆向移动
B.使用催化剂,正反应速率增大,逆反应速率减小
C.若反应体系温度不再变化,说明反应达到平衡状态
D.减小SO2的浓度,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是
A.乙烯的结构简式:CH2CH2
B.乙炔的分子式:C2H2
C.顺-2-丁烯的结构简式:H3CHHCH3
D.乙酸的实验式:C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知某温度时0.01 mol/L NaOH溶液的pH=10,则此温度下水的离子积常数Kw=1.0×10-12。此温度下将pH=12的NaOH溶液V1 L与pH=1的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为 。
(2)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应结束时两溶液的pH均为4。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1 m2(选填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物 B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H D. 该药剂不适合于胃溃疡患者服用
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com