
分析 (1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)正极上发生还原反应,氧气得到电子结合氢离子反应生成水,据此写出正极的电极反应式.
解答 解:(1)能设计成原电池的反应通常是放热反应,
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,该反应为氧化还原反应,且为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)电极总反应为2H2(g)+O2(g)=2H2O(1)△H<0,以H2SO4溶液为电解质溶液,氢氧燃料电池的正极上氧气得到电子结合氢离子生成水,其电极反应式为:O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O.
点评 本题考查原电池的设计和燃料电池的电极反应书写,题目难度中等,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2FeCl2═2FeCl3 | D. | 3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+═Mg(OH)2↓ | |
| B. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| C. | 酸性KMnO4溶液与H2O2反应:2MnO${\;}_{4}^{-}$+10H++3H2O2═2Mn2++3O2↑+8H2O | |
| D. | 向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++3NO↑+5I2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 | 除去氯化钠晶体中混有的氯化铵晶体 | 分离CCl4中的I2 | 分离酒精和水 | 除去CO气体中的CO2气体 |
| 装置 | 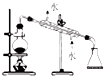 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4. |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 分析氢氧化钠的作用:③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaWO是漂白粉的有效成分 | |
| B. | 原子半径由小到大的顺序:X<Y<Z<W | |
| C. | 室温下,0.1mol/L W的气态氢化物的水溶液的pH>1 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com