
【题目】下列离子方程式书写不正确的是( )
A.利用硝酸银溶液检验Cl﹣:Ag++Cl﹣=AgCl↓
B.向CuSO4溶液中滴加Ba(OH)2溶液:Ba2++SO42﹣=BaSO4↓
C.实验室用大理石块与稀盐酸制取CO2:CaCO3 + 2H+=Ca2++ CO2↑+ H2O
D.氯气溶解于水中:Cl2+H2O![]() H++Cl﹣+HClO
H++Cl﹣+HClO
【答案】B
【解析】
A. 利用硝酸银溶液检验Cl﹣,银离子与氯离子反应生成氯化银沉淀,反应的离子方程式为Ag++Cl﹣=AgCl↓,选项A正确;
B. 向CuSO4溶液中滴加Ba(OH)2溶液,反应生成氢氧化铜沉淀和硫酸钡沉淀,反应的离子方程式为:Ba2++2OH-+Cu2++SO42﹣=BaSO4↓+Cu(OH)2↓,选项B不正确;
C. 实验室用大理石块与稀盐酸制取CO2,碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为CaCO3 + 2H+=Ca2++ CO2↑+ H2O,选项C正确;
D. 氯气溶解于水中,与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O![]() H++Cl﹣+HClO,选项D正确。
H++Cl﹣+HClO,选项D正确。
答案选D。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质及各种微量,分类法的作用几乎是无可替代的。
(1)下列7种微粒 ![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中有____种核素,含有____种元素,其中
中有____种核素,含有____种元素,其中 ![]() 与
与![]() ;____与____互称为____,
;____与____互称为____,![]() 、
、![]() 具有相同的____。
具有相同的____。
(2)现有以下8种物质:① Cu ② BaSO4晶体 ③熔融的NaCl ④Fe(OH)3胶体 ⑤纯硫酸 ⑥CO2 ⑦氯气 ⑧石灰水
①属于混合物的是(填序号,下同)____;
②能导电的单质是____;
③属于电解质的是____;
④属于非电解质的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol
若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式____________。
,请写出此反应的热化学方程式____________。
(2)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:_________________________。
(3)NO2用氨水吸收能生成NH4NO3,25℃时,将amolNH4NO3溶于水配成bL溶液,溶液显酸性,常温下向该溶液通入标准状况下VL氨气后溶液呈中性,则通入氨气的过程中水的电离平衡将_____(填“正向”“不”“逆向”)移动,通入标准状况下氨气的体积为_________L(设通入氨气后溶液的体积不变,用含a的代数式表示,已知常温下NH3·H2O的电离平衡常数为2.0×10-5)
(4)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
5N2+6H2O不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:1、3:1、1:3时,得到NO脱除率曲线如图所示:

①由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是________。
②曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________mg/(m3·s)。
③曲线c对应NH3与NO的物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
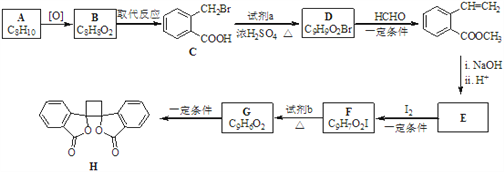
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()
(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
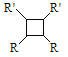
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成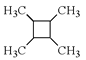 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 甲苯既可使溴的四氯化碳溶液因反应而褪色,也可使酸性高锰酸钾溶液褪色
B. 有机物![]() 的消去产物有两种
的消去产物有两种
C. 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH—COOCH3
D. 可用溴水鉴别苯、四氯化碳和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份质量相等的有机物M,一份与足量的钠反应放出气体V1升,另一份与Na2CO3溶液反应最多放出气体V2升;若同温同压下V1>V2>0,则M可能是
A. CH3COOHB. HOOC—COOHC. HO(CH2)2CHOD. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种溶液:A.盐酸B.稀硫酸C.NaOH溶液D.Ba(OH)2溶液。这些溶液溶质物质的量浓度均为0.3mol/L。根据溶液取用情况,判断得到的溶液中存在的主要离子及其浓度;或者根据最终离子的情况,推断最终溶液可能是哪些溶液按怎样的体积比混合的结果(忽略溶液混合后的体积变化)
溶液取用情况 | 溶液中存在的主要离子及其浓度 |
溶液A和B按体积比2:1混合 | ①____________ |
②____________ | Na+和Cl﹣物质的量浓度均为0.15 mol/L |
等体积混合溶液B和C | ③____________ |
溶液A和D按体积比2:1混合 | ④____________ |
⑤____________ | Ba2+物质的量浓度为0.1 mol/L,OH﹣物质的量浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠 溶液 | 5.0 |
B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是_____________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是______________(答出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() (I)、
(I)、![]() (II)、
(II)、![]() (III)、
(III)、![]() (IV)化合物的说法正确的是
(IV)化合物的说法正确的是
A. Ⅰ、Ⅱ、Ⅲ、Ⅳ的沸点依次升高 B. Ⅰ、Ⅲ的一氯代物均只有四种
C. Ⅱ、Ⅲ中碳原子可能都处于同一平面 D. Ⅲ、Ⅳ都属于芳香族化合物,互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com