
【题目】下列关于糖分解代谢的叙述,错误的是
A. 甜菜细胞中的蔗糖经水解可产生葡萄糖和果糖
B. 各种糖类都可以氧化分解,为细胞供能
C. 发芽小麦种子中的麦芽糖经水解可产生葡萄糖
D. 纤维素经微生物水解可产生葡萄糖
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】[2017天津卷]H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3 ![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+ O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O
2Fe2(SO4)3 +2H2O
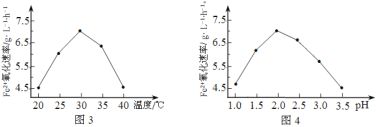
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是______________。
(2)由图3和图4判断使用硫杆菌的最佳条件为______________。若反应温度过高,反应速率下降,其原因是______________。
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为__________。
Ⅱ.SO2的除去
方法1(双减法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:____________________________;CaO在水中存在如下转化:
CaO(s)+ H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理____________________________________。
方法2:用氨水除去SO2
(5)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_________________ mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=___________________。
)=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,能观察到明显现象的是( )
A. 在稀盐酸中滴加NaOH溶液
B. 在AlCl3溶液中滴加NaOH溶液
C. 在NaHCO3溶液中滴加NaCl溶液
D. 在FeCl2溶液中滴加少量H2O2后,再滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属腐蚀的本质是金属与其接触的其他物质在一定条件下发生氧化还原反应而受到损害。下列不属于化学或电化学防腐方法的是( )
A. 在金属表面涂刷一层油漆
B. 利用电镀技术在金属表面镀上一层其他金属
C. 用阳极氧化处理使铝表面形成致密的氧化物膜
D. 利用特殊工艺在钢铁表面生成一层致密的Fe3O4薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列说法不正确的是( )
A. 氯气可以做杀菌消毒剂 B. 过氧化钠可以做呼吸面具的供氧剂
C. 氢氟酸可以雕刻玻璃 D. 二氧化硅可用来制造太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是 ( )
A. 非金属单质燃烧时火焰均为无色
B. 所有金属及其化合物灼烧时火焰均有颜色
C. 焰色反应均应透过蓝色钴玻璃观察
D. NaCl与Na2CO3灼烧时火焰颜色相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物丙是一种香料,其合成路线如图。

已知![]()
乙与苯甲醇(![]() )互为同系物,丙分子中只有两个甲基。
)互为同系物,丙分子中只有两个甲基。
(1)A的分子式是![]() ,分子中有支链,则A的结构简式是__________________;
,分子中有支链,则A的结构简式是__________________;
(2)C和新制![]() 悬浊液反应的化学方程式是____________________________;
悬浊液反应的化学方程式是____________________________;
(3)D能发生银镜反应,分子式为![]() 。
。![]() 与
与![]() 反应,最多消耗_________
反应,最多消耗_________ ![]() ;
;
(4)甲和乙反应生成丙的化学方程式是________________________;
(5)乙的同分异构体中,显弱酸性且苯环上有2个取代基的共有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol1
2NO2(g) ΔH=113.0 kJ·mol1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH= kJ·mol1。
SO3(g)+NO(g)ΔH= kJ·mol1。
一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有 。
A.体系密度保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶5,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。

(3)如图是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为H2O和 (填化学式)。
②当消耗1 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为 L。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com