
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
分析 A.具有相同电子排布的离子,原子序数大的离子半径小;
B.非金属性越强,对应最高价氧化物水化物的酸性越强;
C.非金属性越强,氢化物越稳定;
D.金属性越强,对应最高价氧化物水化物的碱性越强.
解答 解:A.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r(Na+)>r(Mg2+)>r(Al3+),故A正确;
B.非金属性越强,对应最高价氧化物水化物的酸性越强,而HClO、H2SO3均为弱酸,只有H3PO4为最高价含氧酸,H3PO4为中强酸,故B错误;
C.非金属性F>O>S,稳定性为HF>H2O>H2S,故C正确;
D.金属性Pb>Sn>Ge,对应最高价氧化物水化物的碱性为Pb(OH)4>Sn(OH)4>Ge(OH)4,故D正确;
故选B.
点评 本题考查周期表和周期律,为高频考点,把握元素的性质及周期律为解答的关键,侧重分析与应用能力的考查,注意短周期元素的性质比较及规律性知识的应用,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
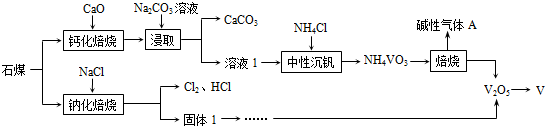
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
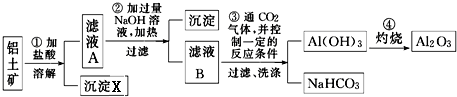
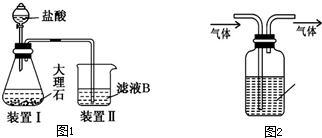
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将a molL-1 HCN溶液与a molL-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 、
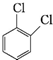
、
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol稀H2SO4与足量NaOH溶液反应 | |
| B. | 稀醋酸与NaOH溶液反应生成1mol H2O | |
| C. | 稀盐酸与稀Ba(OH)2溶液反应生成1mol H2O | |
| D. | 稀NaOH与95%浓硫酸反应生成1mol H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com