
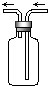
 如图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是( )
如图是化学实验常用装置之一,若气体从右管进入,可用来收集的气体是( ) 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.
绿矾晶体(FeSO4?7H2O)在医药上作补血剂.某同学用KMnO4溶液滴定绿矾晶体(FeSO4?7H2O)样品(杂质不与 KMnO4反应),对铁元素含量进行测定.查看答案和解析>>
科目:高中化学 来源: 题型:
 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
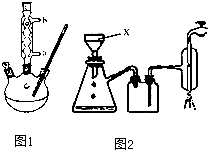 【实验化学】
【实验化学】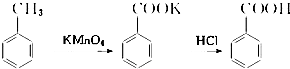
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省某重点高中高一12月月考化学试卷(带解析) 题型:实验题
为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如下图所示的实验装置,按要求回答下列问题。
(1)请根据甲同学的示意图,实验装置从左至右的连接顺序为:
装置②→ → → ;
(2)装置②中主要玻璃仪器的名称___________、___________、___________;
(3)实验室制备Cl2的离子方程式为________________________________;
(4)装置③中Cu的作用 (用化学方程式表示);
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置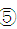 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置
,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置 应放入 。
应放入 。
(6)实验结束,处理多余Cl2的常用试剂是______________,有关反应的离子方程式为______________________________________________。
(7)实验用的AgNO3需配制,下列情况会使所配溶液浓度偏高的是(填序号) ____。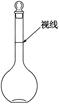
a.某同学观察液面的情况如图所示
b.没进对烧杯、玻璃棒进行洗涤操作
c.定容时,不慎超过了刻度线
d.AgNO3固体称量时,砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高一12月月考化学试卷(解析版) 题型:实验题
为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如下图所示的实验装置,按要求回答下列问题。
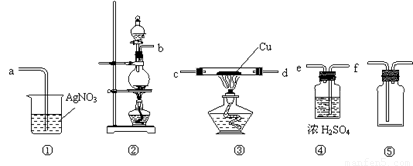
(1)请根据甲同学的示意图,实验装置从左至右的连接顺序为:
装置②→ → → ;
(2)装置②中主要玻璃仪器的名称___________、___________、___________;
(3)实验室制备Cl2的离子方程式为________________________________;
(4)装置③中Cu的作用 (用化学方程式表示);
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置
,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置 应放入 。
应放入 。
(6)实验结束,处理多余Cl2的常用试剂是______________,有关反应的离子方程式为______________________________________________。
(7)实验用的AgNO3需配制,下列情况会使所配溶液浓度偏高的是(填序号) ____。

a.某同学观察液面的情况如图所示
b.没进对烧杯、玻璃棒进行洗涤操作
c.定容时,不慎超过了刻度线
d.AgNO3固体称量时,砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com