
【题目】[化学—选修3:物质结构与性质]
已知X和Y均为短周期元素,其原子的第一至第五电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 | I5 |
X | 801 | 2427 | 3660 | 25026 | 32827 |
Y | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
根据上述信息:
①X和氯元素形成的简单分子的空间构型为 。
②Y的基态原子的核外电子排布式为 ,若Y和氯元素形成的分子的相对分子质量为267,请在下列方框中写出该分子的结构式(若存在配位键,用“→”表示)

(2)碳元素可以形成多种单质及化合物:
①C60的结构如图1。C60中的碳原子的杂化轨道类型是 ;


解释:②金刚石中的C-C的键长大于C60中C-C的键长的原因是 ;
③金刚石的熔点高于C60的原因是 ;
(3)如图2是钾的石墨插层化合物的晶胞图(图中大球表示K原子,小球表示C原子),如图3是晶胞沿右侧方向的投影.

①该化合物的化学式是 ;
②K层与C层之间的作用力是 ;
③K层中K原子之间的最近距离是C-C键的键长dC-C的 倍
(4)SiC的晶胞与金刚石的晶胞相似,设碳原子的直径为a cm,硅原子的直径为b cm,则晶胞的边长为 cm(用含a、b的式子表示)。
【答案】(1)① 平面正三角形。② 1s22s22p63s3,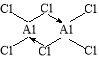
(2)① sp2杂化;② 金刚石中的C—C键为单键,而C60中每个碳原子都以sp2的形式杂化,其2p轨道上还有一个单电子轨道垂直于sp2杂化轨道的平面,相互之间肩并肩重合形成π键,故金刚石中的C-C的键长大于C60中C-C的键长;③ C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,融化时平破坏的是共价键。
(3)① C8K;② 离子键;③ 2;
(4) 。
【解析】
试题分析:
(1)X和Y均为短周期元素,其原子的第一至第五电离能,原子多于5个电子。又由于X、Y都是I4远大于I3,说明最外层都是3个电子。X、Y元素的原子的I1,X大于Y的,故X是B,Y是Al。①X(B)和氯元素形成的简单分子BCl3的中心原子B原子的价层电子无孤电子对,所以其空间构型为平面正三角形;② Y(Al)的基态原子的核外电子排布式为1s22s22p63s3,Y和氯元素形成的分子的相对分子质量为267,其分子是Al2Cl6,Al原子3p有3个单电子,与3个Cl原子形成共价键,还有1个空轨道,可以接收Cl原子提供的孤对电子形成配位键,故其结构式是 。
。
(2)①C60中的每一个碳原子都与3个相邻的碳原子以共价键相结合,故碳原子轨道以 sp2的形式杂化;
②金刚石中的C-C键为单键,而C60中的每个碳原子都以sp2的形式杂化,其2p轨道上还有一个单电子轨道垂直于sp2杂化轨道的平面,相互之间肩并肩重合形成π键,故金刚石中的C-C的键长大于C60中C-C的键长;
③C60是分子晶体,熔化时破坏的是分子间作用力,金刚石是原子晶体,熔化时破坏的是共价键。
(3)①根据均摊法:晶胞中的原子数目分别为K:4×(顶角)+4×(面上)+5(体心)=1+2+5=8,C:4×[8×(面上)+12(体心)]=4×16=64。原子数目这比K:C=8:64=1:8,故该化合物的化学式是C8K;②K属于活泼金属元素,C为非金属元素,二者之间的作用力为离子键;③设晶胞沿右侧方向的投影的边长是2a,宽为a,则K层中K原子之间的最近距离为a,正六边形的内角为120℃,则4dC-C·cos30°=a,故a=2dC-C;
(4)碳化硅的晶胞与金刚石的晶胞相似(如图),碳原子与硅原子最近距离为晶体体对角线的,若晶胞的边长为lcm,则晶体体对角线为lcm=4×(+),故l=。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
【题目】2Zn(OH)2ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2ZnCO3的工艺流程如下:
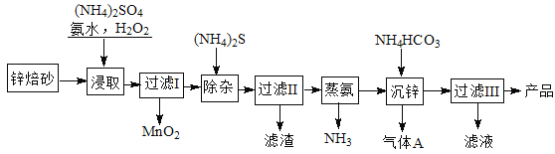
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×1024,Ksp(CuS)=1.3×1036+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)

(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同),其原子结构示意图为 。元素K名称为 在周期表中的位置 。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是: 。]
(3)某元素二价阳离子的核外有10个电子,该元素是 (填元素名称)
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序
(5)F、H、J的最高价氧化物对应水化物的酸性由强到弱的顺序 。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是 。
(7)元素I的氢化物的结构式为 ;该氢化物常温下和元素K的单质反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含有的较少的H+和OH-):Na+、NH4+、SO42-、CO32-、NO3-。取200 mL该溶液,分为两等份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33g。下列说法正确的是
A.该溶液中可能含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+) ≥ 0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
2NH3(g)。2min时测得剩余N2为1mol,此时表示的化学反应速率正确的是( )
A.v(N2)=0.25mol·Lˉ1·minˉ1 B.v(H2)=0.5mol·Lˉ1·minˉ1
C.v(NH3)=1mol·Lˉ1·minˉ1 D.v(NH3)=0.25mol·Lˉ1·minˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容器可变的密闭容器中,反应N2(g)+3H2(g)![]() 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正______(选填“增大”、“减小”,下同),v逆______,平衡向______方向移动(选填“正反应”、“逆反应”)。
(2)在其他条件不变的情况下,降低温度平衡向正反应方向移动,为______反应(选填“吸热”、“放热”)。
(3)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是______(填写编号)。

a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量______(选填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
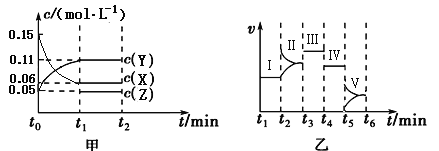
【题目】某实验组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:一定条件下,向一个密闭容器中加入0.30molX、0.10molY和一定量的Z三种气体,甲图表示发生反应后各物质浓度(c)随时间(t)的变化〔其中t0~t1阶段c(Z)未画出〕。乙图表示化学反应速率(v)随时间(t)的变化,四个阶段都只改变一种条件(催化剂、温度、浓度、压强,每次改变条件均不同),已知t3~t4阶段为使用催化剂。
回答下列问题:
(1)若t1=5 min,则t0~t1阶段以X浓度变化表示的反应速率为v(X)= 。
(2)在t2~t3阶段Y的物质的量减小,则此阶段开始时v正 v逆(填“>”、“=”或“<”)。
(3)t4~t5阶段改变的条件为 ,此阶段的平衡常数K = 。
(4)t5~t6阶段容器内Z的物质的量共增加0.10 mol,在反应中热量变化总量为a kJ,写出该反应的热化学方程式 。在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是 。
(5)若起始实验条件不变,重新向该容器中加入0.60 mol X、0.20 mol Y和0.080 mol Z,反应至平衡状态后X的转化率= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸按是一种常用的化肥,其工业生产流程如下图,请回答下列问题。

(1)写出反应容器B中发生反应的化学方程式: 。
(2)吸收塔C中通入空气的目的是 。C、D两个反应容器中发生的反应,属于氧化还原反应的是 (填反应容器代号)。
(3)浓硝酸一般保存在徐色试剂瓶里,并放置在阴凉处,用化学方程式解释原因: 。
(4)3.04g铜镁合金完全溶解于100mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.00mol·L-1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则
① 加小Na0H 溶液的体积至少 mL。
② 该合金中铜与镁的物质的量之比是 。
③ NO2和N2O4的混合气体中,NO2的体积分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g) ![]() 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:21m
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:21m
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H
0;熵变△S 0 ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。

(2)该反应的v-t图像如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图像如图2中右图所示。以下说法正确的是
① a1>a2 ②b1<b2 ③ t1>t2 ④ 右图中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图所示。下列说法正确的是 。

A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点X的浓度:A>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com