
| A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y | B、因为酸性H2SO3>H2CO3,所以非金属性S>C | C、硅、锗都位于金属与非金属的交界处,都可以做半导体材料 | D、Ca和Ba分别位于第ⅡA族第四周期和第六周期,则碱性:Ca(OH)2<Ba(OH)2 |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
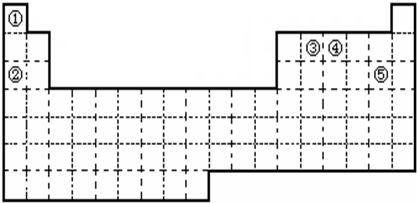
| ||
| ||




| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022

(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可反氢元素放在VIIA族,那么根据其最高正价与最低负
价的绝对值相等,又可反氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
(B)

(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B
(c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源:2013届广东省高一下学期期中考试化学(文)试题 题型:选择题
下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.卤素随核电荷数增加氢化物越来越稳定
D.O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.卤素随核电荷数增加氢化物越来越稳定
D.O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com