
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,并放出X kJ热量.已知单质C(s)的燃烧热为Y kJ/mol,则1mol C(s)与O2(g)反应生成CO(g)的反应热△H为( )
|
| A. | ﹣Y kJ/mol | B. | ﹣(10X﹣Y)kJ/mol |
|
| C. | ﹣(5X﹣0.5Y) kJ/mol | D. | +(10X﹣Y)kJ/mol |
考点:
有关反应热的计算.
分析:
碳在氧气中燃烧,氧气不足发生反应2C+O2 2CO,氧气足量发生反应C+O26
2CO,氧气足量发生反应C+O26 CO2.3.6g碳的物质的量为0.3mol,
CO2.3.6g碳的物质的量为0.3mol,
6.4g的氧气的物质的量为0.2mol,n(C):n(O2)=3:2,介于2:1与1:1之间,所以上述反应都发生.令生成的CO为xmol,
CO2为ymol,根据碳元素与氧元素守恒列方程计算x、y的值,计算生成ymol二氧化碳的热量,放出的总热量减去生成二氧化碳
放出的热量为生成xmolCO放出的热量,据此计算1molC与O2反应生成CO的反应热△H.
解答:
解:碳在氧气中燃烧,氧气不足发生反应2C+O2 2CO,氧气足量发生反应C+O2
2CO,氧气足量发生反应C+O2 CO2.
CO2.
3.6g碳的物质的量为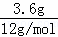 =0.3mol,6.4g的氧气的物质的量为
=0.3mol,6.4g的氧气的物质的量为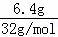 =0.2mol,n(C):n(O2)=3:2,
=0.2mol,n(C):n(O2)=3:2,
介于2:1与1:1之间,所以上述反应都发生.
令生成的CO为xmol,CO2为ymol,
根据碳元素守恒有x+y=0.3,根据氧元素守恒有x+2y=0.2×2,联立方程,解得x=0.2,y=0.1.
单质碳的燃烧热为Y kJ/mol,所以生成0.1mol二氧化碳放出的热量为0.1mol×Y kJ/mol=0.1YkJ,
所以生成0.2molCO放出的热量为XkJ﹣0.1YkJ.
由于碳燃烧为放热反应,所以反应热△H的符号为“﹣”,
故1mol C与O2反应生成CO的反应热△H=﹣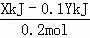 =﹣(5X﹣0.5Y)kJ/mol.
=﹣(5X﹣0.5Y)kJ/mol.
故选C.
点评:
本题考查反应热的计算,难度不大,判断碳与氧气反应产物中一氧化碳与二氧化碳的物质的量是关键,注意反应热△H的单位与符号,容易忽略.


科目:高中化学 来源: 题型:
某有机物A化学式为CxHyOz,15 g A完全燃烧可生成22 g CO2和9 g H2O。试求:
(1)该有机物的最简式 ;
(2)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为 ;
(3)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为____________________________ ;
(4)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素中按微粒半径递增顺序排列的是( )
|
| A. | Li K Na | B. | Ba2+ Ca2+ Mg2+ |
|
| C. | Ca2+ K+ Cl﹣ | D. | N O F |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图:利用Fe+CuSO4=FeSO4+Cu反应设计一个原电池.下列说法中,正确的是( )
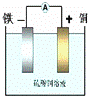
|
| A. | 电解质溶液中阳离子向负极移动 |
|
| B. | 电子通过溶液由负极流向正极 |
|
| C. | 当导线中有1mol电子通过时,理论上正极消耗28克. |
|
| D. | 若所选电极的质量相等,理论上两极质量差为60g,导线中有1mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:
5.7g汽油[主要成分是辛烷(C8H18),平均相对分子质量为114]完全燃烧生成液态水和CO2放出275.9kJ的热量,汽油的燃烧热△H= .
由于石油资源有限,且汽油燃烧会产生严重的污染,未来应该会用氢气作为燃料来取代汽油,生产新型环保汽车.已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol,H2O(l)═H2O(g)△H=+44kJ/mol.
(1)写出氢气和氧气反应生成液态水的热化学方程式
(2)常温下,若要得到857.4kJ的热量,需氢气的质量为 克.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )

|
| A. | 任何化学反应都伴随着能量的变化 |
|
| B. | H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化 |
|
| C. | 化学反应中能量的变化都表现为热量的变化 |
|
| D. | 对于如图所示的过程,是吸收能量的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为原子序数依次增大的短周期元素.已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3,回答:
(1)写出下列元素符号:A 、C 、D ;
(2)A、E两元素最高价氧化物对应水化物相互反应的化学方程式 ;
(3)比较C、D最高价氧化物对应水化物的酸性 .
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
Ⅰ. 氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:
CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:则A点的逆反应速率V(逆)(CO2)<B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 .
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为26.该反应的化学平衡常数的表达式为K= .
Ⅱ.氮的氧化物会污染环境.
(3)采取还原法,用炭粉可将氮的氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol﹣1, C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
写出炭粉还原一氧化氮的热化学反应方程式
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为 .若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com