



 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除去混在氯化钠固体中的氯化铵或单质碘均可用加热升华的方法 |
| B.若FeCl2溶液中含有I-杂质,可用过量的Cl2氧化后进行萃取分液 |
| C.从海水中提取溴,一般是向浓缩后的海水中通入Cl2,再鼓入热空气或水蒸汽将溴分离出来 |
| D.鉴别固体Na2CO3和NaHCO3,可以分别配成溶液,再加入澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.萃取、过滤、蒸馏、蒸馏 | B.过滤、分液、蒸馏、萃取 |
| C.过滤、蒸馏、过滤、蒸馏 | D.过滤、分液、过滤、蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl溶液(BaCl2):加K2SO4溶液,过滤 |
| B.KNO3溶液(AgNO3):加NaCl溶液,过滤 |
| C.NaCl溶液(I2):加酒精,分液 |
| D.KNO3溶液(I2):加四氯化碳,萃取 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
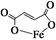 )是一种限量使用的铁强化剂。
)是一种限量使用的铁强化剂。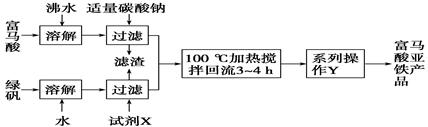
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品1.5 g,加入稀硫酸25 mL,用水稀释至50 mL,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液 |
| ② | |
| ③ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com