
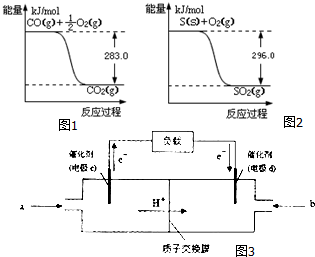
 一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资
一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资分析 (1)①Ni能与氧气反应,据此解答即可;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
利用盖斯定律进行计算即可;
(2)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
来分析求解;
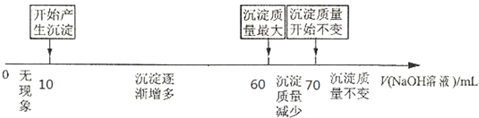
(3)原电池中电子从负极经外电路流向正极,负极反应氧化反应,结合电解质书写电极反应式;根据c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;根据电子得失守恒以及精铜中铜离子得到电子来计算.
解答 解:(1)①Ni能与氧气反应,使Ni失去催化作用;
故答案为:避免O2与Ni反应再使其失去催化作用;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-563-(-298)=-270kJ•mol-1,
故答案为:-270kJ/mol;
(2)设参加反应的CO的浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=$\frac{{x}^{2}}{(0.30-x)^{2}}$,x=0.225,
所以CO的转化率α(CO)=$\frac{0.225mol/L}{0.30mol/L}$×100%=75%,
氢气反应速率v(H2)=$\frac{0.225mol/L}{5min}$=0.045mol/(L•min),
故答案为:75%;0.045mol/(L•min);
(3)甲醇具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,因c为负极,d为正极,粗铜精炼时,粗铜作阳极,与电源的正极d相连,精铜电极电极反应式:Cu2++2e-=Cu,Cu2+的物质的量为=$\frac{64g}{64g/mol}$=1mol,由电子得失守恒可知电子转移2mol,原电池中正极电极反应为4OH--4e-=2H2O+O2↑,则生成氧气物质的量为0.5mol,体积=0.5mol×22.4L/mol=11.2L,故答案为:负极;CH3OH-6e-+H2O=CO2+6H+;d;11.2.
点评 本题考查了催化剂、盖斯定律的应用、化学平衡常数的求算,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L C2H5OH完全燃烧后生成的CO2分子个数约为NA/11.2 | |
| B. | 将lmol Cl2通人水中,HClO、Cl一、ClO-粒子数之和为2NA | |
| C. | 含3.0g HCHO的水溶液中原子总数为0.4 NA | |
| D. | 3.4gNH3中共用电子对数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
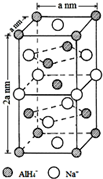 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
. (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭吸附新装修居室里的有害气体 | |
| B. | 用K2Cr2O7检查司机是否酒后驾车 | |
| C. | 用盐酸清洗陶瓷面盆上的铁锈迹 | |
| D. | 用石灰水吸收燃煤烟气中的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com