
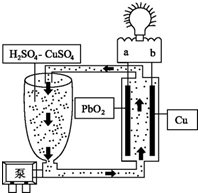
 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )| A. | a为正极,b为负极 | |
| B. | 该电池工作时PbO2电极附近溶液的pH增大 | |
| C. | b极的电极反应为Cu-2e-═Cu2+ | |
| D. | 调节电解质溶液的方法是补充CuSO4 |
分析 根据电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则铜失电子发生氧化反应为负极,反应式为:Cu-2e-═Cu2+,PbO2得电子发生还原反应为正极,反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,以此解答该题.
解答 解:A.根据电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则铜失电子发生氧化反应为负极,PbO2得电子发生还原反应为正极,所以为负极,b为正极,故A正确;
B.PbO2得电子发生还原反应为正极,反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,所以PbO2电极附近溶液的pH增大,故B正确;
C.铜失电子发生氧化反应为负极,反应式为:Cu-2e-═Cu2+,故C正确;
D.由电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则调节电解质溶液的方法是补充H2SO4,故D错误;
故选D.
点评 本题考查了化学电源新型电池,为高频考点,侧重于学生的分析能力的考查,根据原电池原理来分析解答,知道电极上发生的反应即可解答,电极反应式的书写是学习难点,总结归纳书写规律,难度中等.


科目:高中化学 来源: 题型:解答题
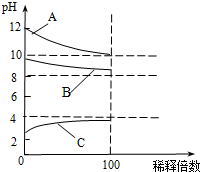 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
科目:高中化学 来源: 题型:解答题
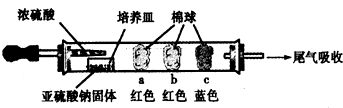
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
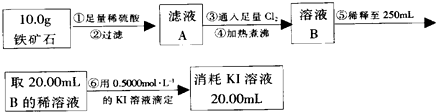
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )
已知某密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),的平衡物质的量浓度c(CO2)与温度t的关系如图所示.下列说法错误的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)较小 | |
| B. | 在t2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| D. | 若t1、t2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
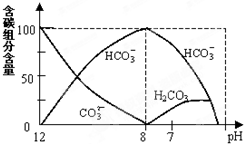 在含有弱电解质的溶液中,往往有多个化学平衡共存
在含有弱电解质的溶液中,往往有多个化学平衡共存查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNa2O2和水完全反应,转移电子数为2NA | |
| B. | 0.5 L 0.2 mol•L-1FeCl3溶液中,含Fe3+离子数为0.1 NA | |
| C. | 理论上氢氧燃料电池负极消耗11.2 L标准状况下气体,外线路通过电子数为NA | |
| D. | 常温常压下,28 g乙烯和丙烯混合气体含有的碳原子总数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为95% | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 将水坝的钢铁闸门与直流电的正极相连可以防闸门腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol•L-1NaClO溶液中阴离子总数大于0.1NA | |
| B. | 7.8gNa2O2中含有的阴、阳离子总数是0.3NA | |
| C. | N2H2分子中各原子的最外层(除H外)均为8电子结构,1molN2H2中有共用电子对数目为3NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜反应,转移电子数小于0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
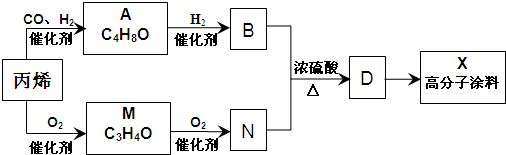
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com