
【题目】向![]() 和
和![]() 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸![]() ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下![]() 和
和![]() 的混合气体及
的混合气体及![]() 。在所得溶液中加入
。在所得溶液中加入![]() 的NaOH溶液
的NaOH溶液![]() ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为![]() 。下列有关说法正确的是
。下列有关说法正确的是
![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]()
![]() 硝酸的物质的量浓度为
硝酸的物质的量浓度为![]()
![]() 、
、![]() 与硝酸反应后剩余
与硝酸反应后剩余![]() 为
为![]()
![]() 产生的
产生的![]() 的体积为
的体积为![]()
![]() 原混合物中Cu的质量分数为
原混合物中Cu的质量分数为![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
在所得溶液中加入![]() 的NaOH溶液
的NaOH溶液![]() ,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为
,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为![]() ,
,![]() ,沉淀为
,沉淀为![]() ,质量为
,质量为![]() ,物质的量为
,物质的量为![]() ,根据铜元素守恒有
,根据铜元素守恒有![]() ,反应后的溶液中
,反应后的溶液中![]() ;
;![]() 。
。
![]() 设Cu和
设Cu和![]() 的物质的量分别为xmol、ymol,根据二者质量有
的物质的量分别为xmol、ymol,根据二者质量有 ![]() ,根据铜元素守恒有
,根据铜元素守恒有![]() ,联立方程解得
,联立方程解得![]() ,
,![]() ,所以
,所以![]() :
:![]() :
:![]() :1,故
:1,故![]() 不正确;
不正确;
![]() 根据N元素守恒可知
根据N元素守恒可知![]() ,
,![]() ,根据Na元素可知
,根据Na元素可知![]() ,所以
,所以![]() ,所以原硝酸溶液的浓度为
,所以原硝酸溶液的浓度为![]() ,故
,故![]() 正确;
正确;
![]() 反应后的溶液中加入氢氧化钠溶液,氢氧化钠与硝酸铜反应,剩余的氢氧化钠与硝酸反应,最后为硝酸钠溶液,根据氮元素守恒可知反应后溶液中
反应后的溶液中加入氢氧化钠溶液,氢氧化钠与硝酸铜反应,剩余的氢氧化钠与硝酸反应,最后为硝酸钠溶液,根据氮元素守恒可知反应后溶液中![]() ,所以Cu、
,所以Cu、![]() 与硝酸反应后剩余
与硝酸反应后剩余![]() ,故
,故![]() 正确;
正确;
![]() 沉淀为
沉淀为![]() ,质量为
,质量为![]() ,物质的量为
,物质的量为![]() ,转移的电子数等于氢氧化铜中氢氧根的物质的量,则
,转移的电子数等于氢氧化铜中氢氧根的物质的量,则![]() ,由
,由![]() ;
;![]() ,得
,得![]() ,所以标准状况下
,所以标准状况下![]() 的体积为
的体积为![]() ,故
,故![]() 错误;
错误;
![]() 原混合物中Cu的质量分数为
原混合物中Cu的质量分数为![]() ,故
,故![]() 错误;
错误;
答案:D。


科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)
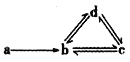
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少二氧化碳的排放、氮氧化物、二氧化硫的处理与利用是一项重要的热点课题。CO2经催化加氢可合成低碳烯烃:![]() 在
在![]() 时,按
时,按![]() :
:![]() :3投料,如图所示不同温度
:3投料,如图所示不同温度![]() 下,平衡时的四种气态物质的物质的量
下,平衡时的四种气态物质的物质的量![]() 的关系。
的关系。
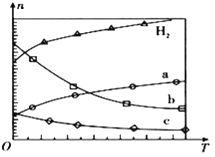
(1)该反应的![]() ______
______ ![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
(2)曲线b表示的物质为 ______
(3)为提高![]() 的平衡转化率,除改变温度外,还可采取的措施是 ______
的平衡转化率,除改变温度外,还可采取的措施是 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,H3A水溶液(一种酸溶液)中含A的各种粒子的分布分数[平衡时某种粒子的浓度占各种粒子浓度之和的分数(α)]与pH的关系如图所示。下列叙述正确的是( )
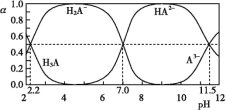
A.根据图,可得Ka1(H3A)≈10-7
B.将等物质的量的NaH2A和Na2HA混合物溶于水,所得的溶液中α(H2A-)=α(HA2-)
C.以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入H3A溶液中,当溶液由无色变为浅红色时停止滴加,则生成NaH2A
D.在上述含A的各种粒子的体系中,若溶液pH为11.5时,则c(H2A-)+5c(A3-)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下: 2CH4(g) ![]() C2H4(g) +2H2(g) ΔH>0
C2H4(g) +2H2(g) ΔH>0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=___________ (用含a.b.c.d的代数式表示)。
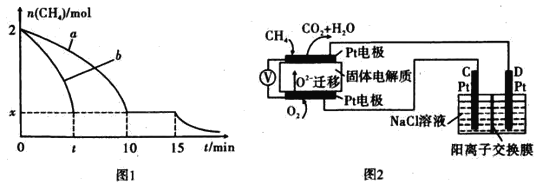
(2)T1温度时,向1 L的恒容反应器中充入2 molCH4 ,仅发生上述反应,反应过程中 0~15 min CH4的物质的量随时间变化如图1所示,测得10-15 min时H2的浓度为1.6 mol/L。
①0~ 10 min内CH4表示的反应速率为____mol/(Lmin) o
②若图中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填"a"或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4).c2(H2) 其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正 ____V逆(填“>”“=”或“<”),判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-
①C极的Pt为_______ 极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________ 。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则阴极区所得溶液c(OH—)=_______ (假设电解前后溶液的体积均为500 mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
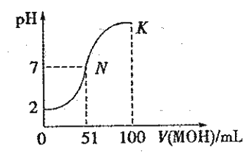
(1)由图中信息可知HA为 酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH = a,则a______________7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: _____________________,此时,溶液中由水电离出的c(OH-)=_________
(3)请写出K点所对应的溶液中离子浓度的大小关系______________________。
(4)K点对应的溶液中,溶液的 pH = 10,则 c(MOH) +c(OH-) =_________________mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图各有机物相互转化关系中,无色气体A为石油裂解的产品之一,A的产量可以用来衡量一个国家石油化工水平,B、D均为日常生活中常见的有机物。
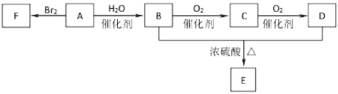
回答下列问题:
(1)由F生成乙二醇的反应条件为_________________________________________。
(2)A生成B的反应方程式为_______________________________________,B生成C的反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s)B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s)D.υ(D)= 1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A.酸性强弱:HX>HY>HZ
B.P点对应的溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)
C.各溶液在滴定过程中任何时刻,溶液中水的电离一直受抑制
D.HZ的电离方程式为:HZ![]() H++Z-
H++Z-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com