
【题目】某同学用如图所示做水果电池的实验,测得数据如下表所示:
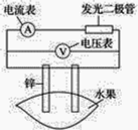
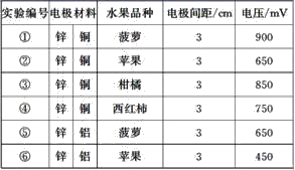
请回答以下问题:
(1)实验⑥中负极的电极反应式为_____________。
(2)实验①、⑤中电流方向相反的原因是_________。
(3)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再接发光二极管,这样做________(填“合理”或“不合理”)。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】如下流程中a、b、c、d、e、f是六种有机物,其中a是烃类,其余是烃的衍生物。下列有关说法正确的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. 若a的相对分子质量是42,则d是乙醛
B. 若d的相对分子质量是44,则a是乙炔
C. 若a为苯乙烯(C6H5—CH===CH2),则f的分子式是C16H18O2
D. 若a为单烯烃,则d与f的最简式一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 3O2(g) == 2O3(g) ΔH>0,则可判定O2(g)比O3(g)稳定
B. 由1 mol H2形成2 mol H要放出热量
C. 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-2Q kJ/mol
2NH3(g) ΔH=-2Q kJ/mol
D. 已知Ni(CO)4(g)=Ni(s)+4CO(g) ΔH=Q kJ/mol(Q>0),则Ni(s)+4CO(g)=Ni(CO)4(g) ΔH=-Q kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol·L-1浓硫酸配制250mL0.9mol·L–1稀硫酸的步骤如下:
①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④ ;⑤转移、洗涤;⑥定容、摇匀;⑦装瓶贴标签
完成下列问题:
(1)计算所需浓硫酸的体积为___。步骤④的内容为___。
(2)容量瓶使用前必须___,容量瓶上需标有以下五项中的___(填序号);
①温度②浓度③容量④压强⑤刻度线
(3)第③步实验的操作中用到的玻璃仪器有___。
(4)下列情况对所配制的稀硫酸浓度有何影响?(选填“偏高”、“偏低”、“无影响”)。
①容量瓶用蒸馏水洗涤后残留有少量的水,则___;
②定容时俯视刻度线,则___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),能说明反应达到平衡状态的是( )
CH3OH(g)+H2O(g),能说明反应达到平衡状态的是( )
A.混合气体中H2O的体积分数保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 molH2,同时生成1 mol CH3OH
D.反应中CO2与CH3OH的物质的量浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒钛磁铁矿炼钢后剩余的尾渣中含有V2O3、MgO、Al2O3、Fe2O3、SiO2等,现从该钒渣中回收V2O3及少量单质铝的工艺流程如下:
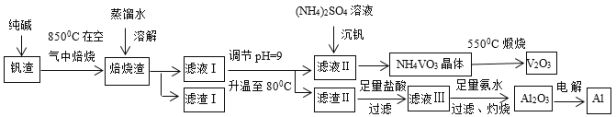
(1)滤液I的成分是NaVO3、NaAlO2和____(写化学式)。
(2)检验滤渣I中含有Fe2O3的方法是____。
(3)写出“焙烧”时生成NaVO3的化学方程式____。
(4)写出滤液Ⅲ与氨水反应生成沉淀的离子方程式____。
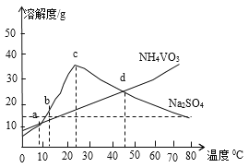
(5)NH4VO3和Na2SO4的混合液需要经过蒸发浓缩、趁热过滤、冷却结晶和过滤等操作得到NH4VO3晶体,结合图分析,为了得到较纯净的NH4VO3晶体和较高的晶体析出率,应选择最适宜的结晶温度为a、b、c、d四点中____点对应的温度。
(6)若经过(5)步骤后得到的是粗NH4VO3晶体,则精制NH4VO3晶体需要采用的操作为____。
(7)滤渣I中有一种成分可作红色油漆,该物质的另外一种用途是____(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒在指定溶液中一定能大量共存的是
A. ![]() =1012的溶液中:CH3CH2OH、MnO4-、K+、SO42-
=1012的溶液中:CH3CH2OH、MnO4-、K+、SO42-
B. 遇苯酚显紫色的溶液中:NH4+、K+、Cl-、SO42-
C. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、SO42-、C6H5OH、Cl-
D. 饱和氨水中:Ag+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理还原CO2制取ZnC2O4的装置如图所示,下列说法正确的是
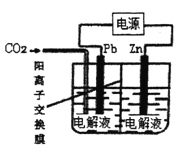
A. Zn电极是阴极
B. C2O42-从左向右移动
C. Pb电极的电极反应式是2CO2-2e-=C2O42-
D. 工作电路中每流过0.02mol电子,Zn电极质量减重0.65g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福建有广阔的海岸线,建设海峡两岸经济区,海水的综合利用大有可为. 海水中溴含量约为65 mg·L-1,从海水中提取溴的工艺流程如图:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是______.
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
______Br2+______CO32-===______BrO3-+______Br-+______CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的化学方程式:_____.
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________.
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com