
【题目】下列物质的俗称和所属类别均不正确的是
选项 | 化学式 | 俗称 | 类别 |
A | C2H6O | 酒精 | 有机物 |
B | NaOH | 苛性钠 | 碱 |
C | Na2CO3 | 烧碱 | 碱 |
D | NaHCO3 | 小苏打 | 盐 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】碳的化合物与人类生产、生活密切相关。
(1)标准状况下,将11.2LCO2通入100mL 1mol/L的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___________;用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+______。
②c(H+)+c(Na+)=_________。
(2)下图是1mol NO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________

(3)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),
Ni(CO)4(g),![]() H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________ (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________ (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,![]() H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(4)二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g)+H2O(l)![]() 2CH3OH(l) △H=+24.52kJ/mol
2CH3OH(l) △H=+24.52kJ/mol
②CH3OH(l)+H2O(l)![]() CO2(g)+3H2(g) △H=+49.01kJ/mol
CO2(g)+3H2(g) △H=+49.01kJ/mol
③CO(g)+H2O(l)![]() CO2(g)+H2(g) △H=-41.17kJ/mol
CO2(g)+H2(g) △H=-41.17kJ/mol
④CH3OH(l)![]() CO(g)+2H2(g) △H=+90.1kJ/mol
CO(g)+2H2(g) △H=+90.1kJ/mol
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,


①你认为反应控制的最佳温度应为___________。
A.300~350℃ B.350~400℃ C.400~450℃ D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 聚乙烯塑料的老化是因为发生了加成反应
B. 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
C. 淀粉、油脂、蛋白质在—定条件下都能发生水解反应
D. 石油的分馏和煤的干馏都是发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们在远距离运输果实或花朵时,装有果实或花朵的密闭容器中,常常放有浸泡过KMnO4(aq)的硅土,其作用是
A.给容器消毒 B.杀死果实周围的细菌,防止霉变
C.延长果实或花朵的寿命 D.催熟果实或花朵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种可充电电池,其设计图如下所示:负极材料是Zn,氧化产物是Zn(OH)2,正极材料是K2FeO4(易溶盐),还原产物是Fe(OH)3,电解质溶液是KOH水溶液。下列有关说法正确的是

A. 高铁电池放电时正极反应为:Zn+2OH--2e-=Zn(OH)2
B. 高铁电池充电时阴极反应为Fe(OH)3+5OH--3e-=FeO42-+4H2O
C. 高铁电池放电时的总反应为:2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D. 高能碱性电池比高铁电池工作电压更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能发生消去反应且产物只有一种的是
A. (CH3)3COH B. CH3OH C. CH3CHICH2CH3 D. (CH3)3C-CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途。如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
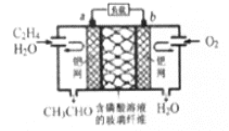
A. 该电池电极a为正极,b为负极
B. 电子移动方向:电极a→磷酸溶液→电极b
C. 负极反应式为:CH2=CH2-2e-+H2O=CH3CHO+2H+
D. b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应
查看答案和解析>>
科目:高中化学 来源: 题型:
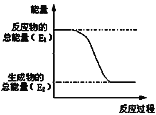
【题目】“西气东输”中的“气”指天然气,其主要成分的化学式是________,结构式是__________。一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1______E2(填“>”或“<”),该反应_______ (填“放出”或“吸收”)能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)基态锌原子的价电子排布式是_____________。
(2)根据元素周期律,电负性Se______S,第一电离能Se________As(填“>”或“<”)。
(3)H2Se的分子构型是___________,其中Se的杂化轨道类型是___________。
(4)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(5)晶体Zn为六方最密堆积,其配位数是_______________。
(6)在硒化锌ZnSe晶胞中,Se2—离子作面心立方最密堆积,且Se2—与Se2—之间的最短距离为a nm,则晶胞边长为_____________ nm。
(7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com