
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
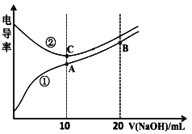
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A、C两点对应溶液均呈中性
C. B点溶液中:c(Na+) > c(OH-) > c(CH3COO-)
D. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L
【答案】B
【解析】溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入KOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着KOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应式离子浓度最小,继续加入KOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1 mol/L NaOH溶液滴定HCl溶液的滴定曲线,曲线①代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,选项A正确;B.A点溶质为醋酸钠,醋酸钠水解溶液呈碱性,C点溶质为NaCl,溶液呈中性,选项B不正确;C、B点为等物质的量浓度的醋酸钠和NaOH,c(Na+)最大 ,CH3COO-水解产生OH-,c(OH-) > c(CH3COO-),故c(Na+) > c(OH-) > c(CH3COO-),选项C正确; D.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,选项D正确。答案选B。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】某化学学习小组为了探究镁和二氧化硫的反应产物,进行如下实验。
Ⅰ.设计如图所示装置完成镁和二氧化硫的反应。

(1)宓验室用亚疏酸钠与浓硫酸反应制备SO2,利用的是浓硫酸的___________
a.强氧化性 b.强酸性 c.脱水性 d.腐蚀性
(2)B装置中试剂的名称是_____________;E装置的作用是_________________。
Ⅱ.探究燃烧的反应产物
(3)反应后取C装置中的固体粉末于烧瓶F中,加入稀硫酸,有气体生成
①产生的气体中含有氢气,则可说明固体中含有______________
②将产生的气体通入硫酸铜溶液,出现黑色沉淀,这一现象的原因是______________ (用离子方程式表示)
(4)取出F装置烧瓶中的混合物,经过滤、干燥得到少量固体粉末,为了探究固体粉末的成分,选择下列装置进行实验:
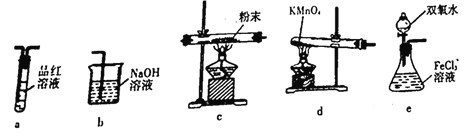
①按气体从左至右,选择所需装置,正确的连接顺序为______________(字母 )
②能证明固体粉末是硫磺的实验现象是_____________________。
(5)经测定,镁在二氧化硫中燃烧生成产物中有硫化镁、硫和氧化镁。如果m(MgO):m(MgS):m(S)=20:7:4,写出镁与SO2在加热条件下反应的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习金属及其化合物的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,并将其转化关系绘制如图。其中A、B、C、D四种物质都含有一种共同的元素,A是常见的金属单质。

(1)若组成A的元素为第3周期元素,B、D分别为常见的两性氧化物和两性氢氧化物。
①用NaOH溶液可使C→D发生转化,该反应的离子方程式是______。
②A→C和B→C均在盐酸的作用下发生,得到等量C时,消耗的HCl的物质的量之比是______。
(2)若A为铁,D的水溶液是红色溶液,C→D的转化常用来检验C在溶液中所含的阳离子。
①C→D的转化中,常加入的试剂是______。
②下列说法正确的是______(填序号)。
a. A→C和B→C的转化均可在Cl2的作用下发生
b.图中的转化均为氧化还原反应
c.B和C中所含金属元素的化合价可以相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F可以用于制备高吸水性树脂聚丙烯酸钠,其合成路线如下:

请回答:
(1)D→E的反应类型_______反应。
(2)F中所含官能团的名称是______。
(3)试剂a是______。
(4)B→C的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的Na+、Mg2+、Cl﹣、Br﹣等化学资源。以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品。
(1)从海水中提取镁的主要步骤如下:

①操作a的名称是______。
②A与试剂X反应的离子方程式是______。
(2)空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴。步骤Ⅰ:用氯气置换溴离子使之成为单质溴;步骤Ⅱ:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化 成氢溴酸;步骤Ⅲ:用氯气将氢溴酸氧化得到产品溴。
①下列说法正确的是______(填序号)。
a.步骤Ⅰ和步骤Ⅱ的目的是使溴富集
b.上述步骤中的反应可说明氧化性:Cl2>Br2
c.步骤Ⅰ和步骤Ⅲ发生的主要反应的原理不同
②若在步骤Ⅱ中消耗的SO2的质量为6.4×103 g,则上述过程中理论上消耗的氯气的体积在标准状况下至少是______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“太空金属”的钛(Ti),在自然界中主要以金红石(TiO2)的形式存在.由于金红石熔点高,为金属Ti的直接制备带来了困难.在工业上常常采用将其先转化成熔沸点较低的TiCl4后再进行还原的方法.金红石转化成TiCl4的反应方程式如下:
TiO2+2C+2Cl2═TiCl4+2CO
(1)指出该反应的氧化剂 ,氧化产物 ;
(2)用双线桥法标出电子转移;
(3)当有6mol电子转移,则有 mol还原剂被氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是
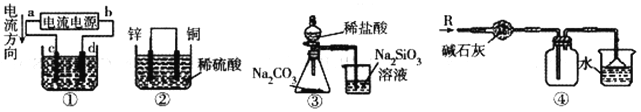
A. 若采用装置①铝件镀银,则c 极为铝件,d 极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③可证明非金属性Cl>C>Si
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
B. 31g白磷中含有的P-P键数目为NA
C. 标况下22.4L戊烷含有分子数目大于NA
D. 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com