
����Ŀ����֪Ԫ�� X λ�� Y ����һ���ڣ�X��Y ��ԭ�������������� 20��ij�������μĻ�ѧʽΪ XYO3����ش�
��1�������� Y �ĵ�������ˮ������Ӧ���� X �����ڱ��е�λ��_________________��X��Y �γɼ����Ӱ뾶��С��ϵΪ X_____________Y����������������С������������������395��ʱ�����ܷ����ֽⷴӦ���������Σ�һ���Ǻ� Y Ԫ�ص��������Σ��÷�Ӧ�Ļ�ѧ����ʽ��_____________________��
��2�������������ᷴӦ��������ɫ����ζ�������ҡ���
���ҵĵ���ʽΪ_______________________��
�ڼ���ˮ�г�����������һ�ָ����ܵ����ʲ��ݳ������ң��÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��3������������ˮ���Ҽ������ᷴӦ������ʹƷ����Һ��ɫ�����塣
�� ���Ϊ_______���ѧʽ������������ʹ���������Һ��ɫ���÷�Ӧ�����ӷ���ʽΪ________��
�� 25��ʱ������ˮ�еij����ܽ�ƽ����������ͼ��ʾ����Ҫʹ��Һ X2+���ӳ�����ȫ������� YO32-���ӵ���СŨ��Ϊ___________molL��1��

���𰸡� �������ڡ��� IA �� С�� 4KClO3 ![]() 3KClO4 + KCl
3KClO4 + KCl ![]() MgCO3 + H2O
MgCO3 + H2O![]() Mg(OH)2 + CO2�� CaSO3 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ 2.1��10-2
Mg(OH)2 + CO2�� CaSO3 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ 2.1��10-2
����������1���������μĻ�ѧʽΪXYO3����XΪ������YΪ�ǽ�����X��Y��ԭ��������������20��X�ĵ�������ˮ������Ӧ����Ԫ��XΪK��Xλ��Y����һ���ڣ���Ԫ��YΪCl��Ԫ��XΪK��K���������Ϊ19����4�����Ӳ㣬�������1�����ӣ�λ�����ڱ��е������ڵڢ�A�壻X��Y�γɼ����ӣ����������Ų���ͬ����˴�С��X�˵����19��Y�˵����17����XС��Y���������μĻ�ѧʽΪKClO3��KClO3�ܷ����ֽⷴӦ���������Σ�һ���Ǻ�ClԪ�ص��������Σ��ɵ��ӡ�ԭ���غ��֪�÷�Ӧ�Ļ�ѧ����ʽ�� 4KClO3 ![]() 3KClO4 + KCl����2�����������ᷴӦ��������ɫ����ζ�������ң��Ҽ���ˮ�г�����������һ�ָ����ܵ����ʲ��ݳ������ң����ΪMgCO3����ΪCO2�����ҵĵ���ʽΪ
3KClO4 + KCl����2�����������ᷴӦ��������ɫ����ζ�������ң��Ҽ���ˮ�г�����������һ�ָ����ܵ����ʲ��ݳ������ң����ΪMgCO3����ΪCO2�����ҵĵ���ʽΪ![]() ���ڼ���ˮ�г�����������һ�ָ����ܵ����ʲ��ݳ������ң��÷�Ӧ�Ļ�ѧ����ʽΪMgCO3 + H2O
���ڼ���ˮ�г�����������һ�ָ����ܵ����ʲ��ݳ������ң��÷�Ӧ�Ļ�ѧ����ʽΪMgCO3 + H2O![]() Mg(OH)2 + CO2������3������������ˮ���Ҽ������ᷴӦ������ʹƷ����Һ��ɫ�����壬�������ΪSO2���˷�ӦΪ���ֽⷴӦ����Ӧǰ��Ԫ�ؼ�̬���䣬����к�SԪ����Ϊ+4�ۣ����ݻ��ϼ۴�����Ϊ0����XSO3��Ԫ��X+2�ۣ��Ҽ�������ˮ����Ԫ��XΪCa����ΪCaSO3���������Ϸ����ã���ΪCaSO3��SO2������ط���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ5SO2+2MnO4��+2H2O=2Mn2��+5SO42��+4H������25��ʱ���ɼ���ˮ�еij����ܽ�ƽ������ͼ��֪Ksp=0.3��10-5mol��L��1��0.7��10-5mol��L��1=2.1��10-11mol��L��1����Ҫʹ��ҺX2�����ӳ�����ȫ�������YO32�����ӵ���СŨ��Ϊ2.1��10-11/1��10-5=2.1��10-7mol��L��1��
Mg(OH)2 + CO2������3������������ˮ���Ҽ������ᷴӦ������ʹƷ����Һ��ɫ�����壬�������ΪSO2���˷�ӦΪ���ֽⷴӦ����Ӧǰ��Ԫ�ؼ�̬���䣬����к�SԪ����Ϊ+4�ۣ����ݻ��ϼ۴�����Ϊ0����XSO3��Ԫ��X+2�ۣ��Ҽ�������ˮ����Ԫ��XΪCa����ΪCaSO3���������Ϸ����ã���ΪCaSO3��SO2������ط���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ5SO2+2MnO4��+2H2O=2Mn2��+5SO42��+4H������25��ʱ���ɼ���ˮ�еij����ܽ�ƽ������ͼ��֪Ksp=0.3��10-5mol��L��1��0.7��10-5mol��L��1=2.1��10-11mol��L��1����Ҫʹ��ҺX2�����ӳ�����ȫ�������YO32�����ӵ���СŨ��Ϊ2.1��10-11/1��10-5=2.1��10-7mol��L��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧͨ�����������Ʊ�������ͭ��
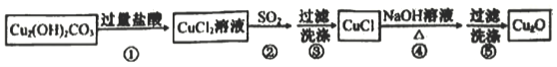
��֪CuCl������ˮ��ϡ���Cu2O+2H+==Cu2++Cu+H2O
����˵������ȷ����
A. �����SO2����Na2SO3�滻
B. �������Ϊ��ֹCuCl������������SO2ˮ��Һϴ��
C. ����ܷ�����Ӧ�����ӷ���ʽΪ2CuCl+2OH-=Cu2O+2Cl-+H2O
D. ���Cu2O�����л���CuCl��CuO���ʣ�������ϡ������Cu2O������ַ�Ӧ�����ݷ�Ӧǰ������������ɼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʢ�NaCl�����CO2��Һ̬�Ĵ������ͭ��BaSO4��������Ǣ߾ƾ��ఱˮ����ش��������⣨����ţ�
��1���ܵ������
��2�����ڵ���ʵ���
��3�����ڷǵ���ʵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ�õ�������ҩƷ��ʵ�������ȷ����( )
A | B | C | D |
|
|
|
|
��ȡ��ϩ����֤�仹ԭ�� | �������� NaOH���� | ��ý�����װ��(����CaF2-CaO �������)�����øƻ�ԭ TiO2 �Ʊ������ѣ��Ʊ�������ǰ��װ���� CaO ���������� | ȷ��ȡһ�����K2Cr2O7����Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͼʾ˵����ȷ���ǣ� ��

A. ͼ��Ϊ����ȼ�ϵ�ؽ���ˮ�е��Ҷ���[H2N(CH2)2NH2]�����ɻ����Ѻõ����ʣ� (a��b ��Ϊʯī�缫����a �缫������Ӧ��H2N(CH2)2NH2+16e-+4H2O==2CO2��+N2��+16H+
B. ͼ�ұ�ʾ��Ӧ�����С�����������
C. �������� 10mL 0.1mol/L ��ij��(HA) ��Һ����μ��� 0.1mol/L �İ�ˮ��������Һ�� pH��������������백ˮ�������ϵ��ͼ��b �� HA ��Һ�백ˮǡ����ȫ��Ӧ
D. ͼ����ʾ��Ӧ N2(g)��3H2(g)![]() 2NH3(g)ƽ��ʱ NH3�����������ʼ n(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)����B(H2)
2NH3(g)ƽ��ʱ NH3�����������ʼ n(N2)/n(H2)�仯�����ߣ���ת���ʣ���A(H2)����B(H2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ij��ɫ��Һ�м����Ȼ������а�ɫ�������ټ�ϡ�����������ʧ�������Һ��
A.һ������SO42��B.һ������Ag+
C.���ܺ���SO42����Ag+D.һ������Ag+��SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п��гɹ��������ҹ�����������ǣ�������
A.�����ϵ�һ�����˹��ϳɵġ������������Եĵ����ʩ����ᾧţ�ȵ���
B.�ڻ�ҩ����ֽ
C.����Ԫ��������
D.�����صĺϳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ�У���ȷ���ǣ�������
A.H2SO4=H2++ SO42- B.Ba(OH)2=Ba2++OH��
C.NaNO3=Na++NO3-D.K2SO4=K2++SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 mol��L��1���������ʵ�ˮ��Һ���ӳ��¼�����100 ������Һ��pH���ֲ������
A���Ȼ��� B���������� C������� D������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com