
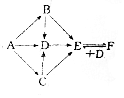
 有A、B、C、D、E、F六种物质,其中A是金属单质,灼烧时火焰呈黄色,C为淡黄色固体,其他均为白色固体,它们之间的相互转化关系如图所示(反应条件及其他产物均已略去).
有A、B、C、D、E、F六种物质,其中A是金属单质,灼烧时火焰呈黄色,C为淡黄色固体,其他均为白色固体,它们之间的相互转化关系如图所示(反应条件及其他产物均已略去).分析 A是金属单质,灼烧时火焰呈黄色,C为淡黄色固体,则A为Na,C为Na2O2,由转化关系可知D为NaOH,B为Na2O,E为Na2CO3,F为NaHCO3,以此解答该题.
解答 解:(1)由以上分析可知A为Na,B为Na2O,故答案为:Na;Na2O;
(2)C为Na2O2,E为Na2CO3,C→E的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,F为NaHCO3,D为NaOH,F+D→E的化学方程式为NaOH+NaHCO3=Na2CO3+H2O,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;NaOH+NaHCO3=Na2CO3+H2O.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,题目涉及钠以及化合物的性质,注意把握物质的性质以及反应的转化特点,难度不大,A是金属单质,灼烧时火焰呈黄色,C为淡黄色固体为解答该题的突破口.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | [H+][OH-]=10-14mol2•L-2的溶液中:NH4+,Na+,SO42-,NO3- | |
| B. | pH=13的溶液中:Cu2+,K+,Cl-,NO3- | |
| C. | 滴入石蕊试液变红的溶液中:Ba2+,Na+,NO3-,HCO3- | |
| D. | NH4NO3溶液中:Na+,Al3+,Cl-,SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的氢离子和氢氧根离子的浓度之比为106:1 | |
| B. | 溶液中c(H+)•c(OH-)=1×10-14 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 溶液中c(NH3•H2O)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
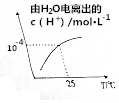 某溶液中由水电离出的c(H+)随温度的变化如图所示,则该溶液可能为( )
某溶液中由水电离出的c(H+)随温度的变化如图所示,则该溶液可能为( )| A. | 稀硫酸 | B. | NaCl溶液 | C. | NH4NO3溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2不能与KNO3溶液反应,推测SO2也不能与KNO3溶液反应 | |
| B. | 由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3Br2=2FeBr3”反应也能发生 | |
| C. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| D. | Zn(OH)2能与氨水反应,则Al(OH)3也能与氨水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向左移动 | |
| B. | 加入少量NaOH固体,平衡向右移动 | |
| C. | 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | a=1.64 | |
| B. | 此时刻正反应速率大于逆反应速率 | |
| C. | 0-10min内平均反应速率v(CH3OH)=1.6 mol/(L•min) | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com