
 采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O.
采用MnO2.其工作原理如图丙所示.电池放电时Na+由a(填写“a”或“b”,下同)极区移向b极区,该电池的负极反应式为BH4-+8OH--8e-=BO2-+6H2O. 分析 (1)CuFeS2中Cu、Fe的化合价为+2价,S为-2价;利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红;
(2)溶液中存在氢氧化镁的溶解平衡,电离出的氢氧根离子可与铵根离子结合生成一水合氨,平衡右移;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu;
(4)NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,正极上H2O2发生还原反应,负极电极方程式为BH4-+8OH--8e-=BO2-+6H2O,阳离子向正极移动.
解答 解:(1)CuFeS2中Cu、Fe的化合价为+2价,S为-2价,
利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红,需要的操作为溶解、过滤、灼烧,不需要蒸发结晶,
故答案为:+2;C;
(2)溶液中存在氢氧化镁的溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),电离出的氢氧根离子可与氯化铵电离出的铵根离子结合生成一水合氨,平衡右移,促进Mg(OH)2的溶解,
故答案为:溶液中存在Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入氯化铵溶液浸泡时,发生NH4++OH-=NH3•H2O,平衡右移,促进Mg(OH)2的溶解;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,转移0.2mol电子,
阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu,则阴极析出0.1molCu,质量为m(CuCl2)=0.1mol×135.5g/mol=13.5g,则若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入13.5gCuCl2,
故答案为:0.2;13.5gCuCl2;
(4)NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,阳离子向正极移动,正极上H2O2发生还原反应,得到电子生成OH-,其电极反应为:H2O2+2e-=2OH-,负极电极方程式为BH4-+8OH--8e-=BO2-+6H2O,故答案为:a;b;BH4-+8OH--8e-=BO2-+6H2O.
点评 本题考查较为综合,为高考常见题型,侧重于学生分析能力和计算能力的考查,题目涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意化合价的变化.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
 某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:
某学习小组探究NaHCO3、Na2HCO3和盐酸(盐酸浓度均为1mol.L-1)反应过程中的热效应,实验测得如下数据:| 序号 | 35mL试剂 | 固体 | 混合温度前/℃ | 混合温度后/℃ |
| ① | 水 | 2.5gNaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2gNa2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5gNaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2gNa2CO3 | 20.0 | 25.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
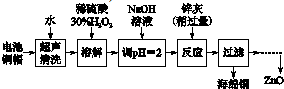
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
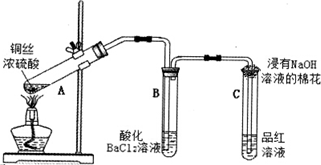
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
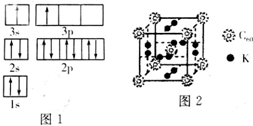 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-)的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
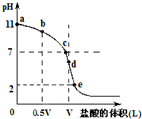 常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
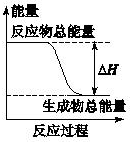
| A. | 由Zn和稀H2SO4反应制取氢气 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | D. | 碳酸钙的分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com