
10 g Mg、Al合金与足量100 mL NaOH溶液反应,产生H2的体积为6.72 L(标准状况下),求:
(1)合金中Al的质量分数;
(2)生成物NaAlO2的物质的量浓度(假设溶液体积不变)
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源:2015-2016学年福建省高二上学期期中(文)化学试卷(解析版) 题型:选择题
能用于治疗胃酸过多的是
A.胃舒平[主要成分Al(OH)3] B.阿司匹林 C.青霉素 D.烧碱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.已知:①C(s,石墨)+O2(g)=CO2(g) ;△H= -393.5 kJ﹒mol-1 ,②C(s,金刚石) +O2(g)=CO2(g) ;△H= -395.0kJ﹒mol-1 ,则石墨比金刚石能量高,石墨比金刚石更稳定
B.已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ; △H 1,②CH3OH(g)+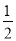 O2(g)= CO2(g)+2H2(g); △H2,则CH3OH(g)+
O2(g)= CO2(g)+2H2(g); △H2,则CH3OH(g)+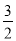 O2(g)= CO2(g)+2H2O(g) ;△H = - (3×△H2 - 2×△H1)
O2(g)= CO2(g)+2H2O(g) ;△H = - (3×△H2 - 2×△H1)
C.已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+ Cl2 (g)=2HCl(g)的反应热△H = -[2×E3 - (E1+E2)]
D.已知:20℃时AgCl、Ag2S的溶解度分别是1.5×10-4 g 、1.3×10-16 g,则向1mL 0.1mol﹒L-1 AgNO3溶液中滴加NaCl溶液,再滴加Na2S溶液,只有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
(2011·泰安高二期末考试)下列各选项所述的两个量中,前者一定大于后者的( )
A.纯水在100℃和25℃时pH
B.NH4Cl溶液中NH和Cl-的数目
C.相同温度下,pH相同的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-)
D.用0.1 mol/L的盐酸中和pH、体积均相同的氨水和NaOH溶液,所消耗盐酸的体积
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省、高安二中高二上期中联考化学试卷(解析版) 题型:实验题
羟基是重要的官能团。某化学小组以下列4种物质的溶液作为研究对象,比较不同物质的羟基中氢原子的活泼性。①碳酸 ②乙醇 ③苯酚 ④乙酸
I.甲同学设计并实施了如下实验方案,请完成(1)(2)(3)(4)的填空及结论。
编号 | 实验操作 | 实验现象 | 结论及解释 |
1 | 分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①④溶液 | 略 |
2 | 向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 | 滴加③时反应的化学方程式: (1)___________ |
3 | 用一定浓度的醋酸溶液浸泡水垢(水垢主要成分为碳酸钙) | (2)__________ | 略 |
4 | 将CO2通入C6H5ONa溶液中 | (3)__________ | 反应的化学方程式: (4)_____________ |
结论: 4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号)_____________。 | |||
II.乙同学在研究了甲同学的实验方案后,提出如下改进方案,能一次比较乙酸、碳酸和苯酚的羟基中氢原子的活泼性,实验仪器如下图所示。
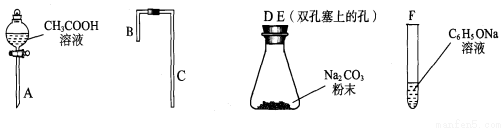
(1)利用上述仪器组装实验装置,其中A管插入(填字母,下同)_______中,B管插入E中,C管插入_________中。
(2)丙同学查资料发现乙酸有挥发性,于是在试管F之前增加了一个盛有_____________溶液的洗气装置,使乙同学的实验设计更加完善。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省简阳市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列溶液中,c( Cl- )与50mL 1mol/L AlCl3溶液中c(Cl- )相等的是
A.75mL 1mol/L的FeCl3溶液 B.75mL 2mol/L的NH4Cl溶液
C.100mL 1.5mol/L的KCl溶液 D.150mL 1mol/L 的NaCl溶液
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期12月月考化学试卷(解析版) 题型:选择题
铜锌原电池(如下图)工作时,下列叙述正确的是( )
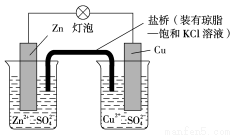
A.正极反应为:Zn -2e- ===Zn2+
B.电池反应为:Zn+Cu2+=== Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+ 移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上第三次月考化学试卷(解析版) 题型:填空题
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。
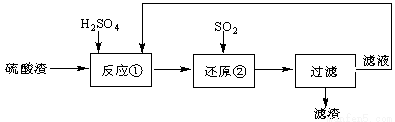
(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
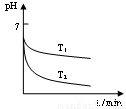
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2 = Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上12月月考化学试卷(解析版) 题型:选择题
2.3g纯净物金属钠在干燥空气中被氧化后得到3.5g固体,由此判断其氧化产物为
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com