
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障,但低空的臭氧浓度过大,会给生物造成伤害 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,还有净水作用 |
分析 A.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉;炼铁的原料:铁矿石、焦炭、石灰石;
B.臭氧层能够吸收太阳紫外线,在低空的臭氧是污染气体,人体吸收后加速氧化;
C.碱性氧化物是和酸反应生成盐和水的氧化物,过氧化钙属于过氧化物;
D.K2FeO4代杀菌消毒,被还原为铁离子水解生成氢氧化铁胶体具有吸附作用可以净水.
解答 解:A.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉;炼铁的原料:铁矿石、焦炭、石灰石,因此工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料,故A正确;
B.高空臭氧层吸收太阳紫外线,保护地球生物;低空臭氧是污染气体,人体吸收后加速氧化,对人体有危害,故B正确;
C.碱性氧化物是和酸反应生成盐和水的氧化物,过氧化钙属于过氧化物,不是碱性氧化物,故C错误;
D.K2FeO4代杀菌消毒,被还原为铁离子水解生成氢氧化铁胶体具有吸附作用可以净水,故D正确;
故选:C.
点评 本题考查了物质组成和分类的分析判断,把握物质的性质及化学与生活、环境保护的关系为解答的关键,侧重分析能力及知识应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Ba2+、NO3-、CO32- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
以下食品中的有机成分属于高分子化合物的是
A.谷类中含有的淀粉 B.植物油、动物脂肪中含有的油脂
C.食醋中含有的醋酸 D.酒中含有的酒精
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 已知石墨比金刚石稳定,则C(s,石墨)→C(s,金刚石)△H>0 | |
| C. | 表示中和热的热化学方程式:H+(l)+OH-(l)═H2O(l)△H=-57.3 kJ/mol | |
| D. | 测定中和热的实验中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热△H<-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
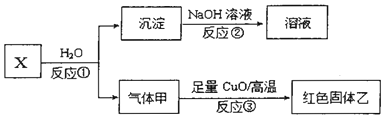
 写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.
写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
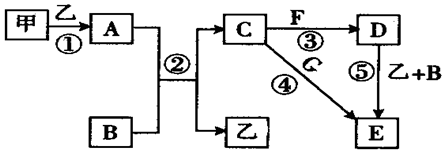
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
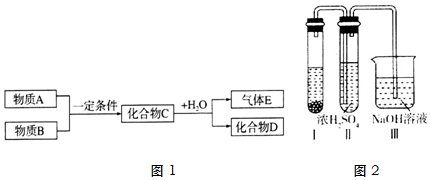
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com