
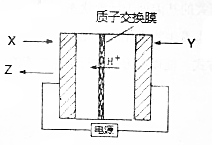
 氨是生产氮肥、尿素等物质的重要原料,电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料,电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | 图中所示物质中,X为H2,Y为N2 | |
| B. | Y参与的电极反应为H2+2e-═2H+ | |
| C. | 当有3gH+通过质子交换膜时,Z的体积为22.4L | |
| D. | 反应过程中左边区域溶液PH逐渐升高 |
分析 根据H+离子移动方向可知,Y连接电源正极、X连接电源负极,则X端为阴极,Y端为阳极,故通入H2的一极为化合价升高,发生氧化反应,该极为阳极Y端;合成氨的阴极X端上氮气得到电子生成氨气,据此分析解答.
解答 解:根据H+离子移动方向可知,Y连接电源正极、X连接电源负极,则X端为阴极,Y端为阳极,
A.通入H2的一极为化合价升高,发生氧化反应,该极为阳极Y端,即X为N2,Y为H2,故A错误;
B.Y端为阳极,H2失电子发生氧化反应,电极反应为:H2-2e-=2H+,故B错误;
C.当有3g即3molH+通过质子交换膜时,则生成1mol氨气,由于不是标况下,无法计算氨气的体积,故C错误;
D.反应过程中左边X端为阴极,氮气得到电子结合氢离子生成氨气,所以pH逐渐升高,故D正确;
故选D.
点评 本题考查了原电池、电解池工作原理,题目难度中等,正确判断电极为解答关键,注意熟练掌握原电池、电解池工作原理,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:W<Z<X | |
| C. | Z与W、Y形成的化合物中,其化学键类型不相同 | |
| D. | 最高价氧化物的水化物的酸性:W<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
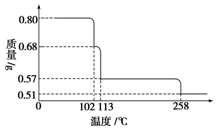 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
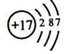 .
.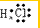 ;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为
;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为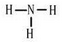 ,四种元素对应的化学性质最稳定的单质的电子式为
,四种元素对应的化学性质最稳定的单质的电子式为 .
.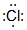 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①② | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com