
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
C.混合溶液的pH=7
D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
I.配制酸性KMnO4标准溶液:下图是配制50 mL酸性KMnO4标准溶液的过程示意图。
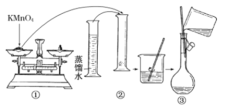
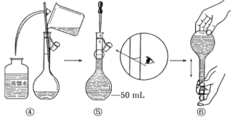
(1)请你观察图示并判断其中不正确的操作有______________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________________(填名称)。
(3)如果按照图示的操作配制溶液,在其他操作均正确的情况下,配制溶液的浓度将______(填“偏大”或“偏小”)。
II.测定血液样品中Ca2+的浓度:取血液样品20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1酸性 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL酸性KMnO4溶液。
(4)请写出草酸与酸性KMnO4溶液反应的离子方程式 ____________________________。
(5)滴定时,根据现象_________________________,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为______________mg·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,正硅酸锂(Li4SiO4)能与CO2发生反应,对控制CO2的排放具有重要的理论意义和实用价值。完成下列填空:
(1)硅原子核外电子占有_____种能量不同的轨道;Li、C、Si的最高价氧化物中,属于原子晶体的是_____。
(2)钠元素的金属性比锂强,用原子结构的知识说明理由_____。
一定温度下,在2L的密闭容器中,Li4SiO4与CO2发生如下反应:Li4SiO4(s)+CO2(g)![]() Li2SiO3(s)+Li2CO3(s)。
Li2SiO3(s)+Li2CO3(s)。
(3)该反应的平衡常数表达式K=_____,反应20min,测得容器内固体物质的质量增加了8.8g,则0~20min内CO2的平均反应速率为_____。
(4)在T1、T2温度下,恒容容器中c(CO2)随时间t的变化关系如图所示。该反应是_____反应(选填“放热”或“吸热”)。
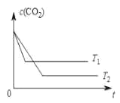
若T1温度下,达到平衡时c(CO2)为amol·L-1,保持其他条件不变,通入一定量的CO2,重新达到平衡时c(CO2)为bmol·L-1。试比较a、b的大小,并说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究燃料的燃烧效率和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g) = H2O(g) ![]() H= 242.0 kJ/mol
H= 242.0 kJ/mol
C(s)+1/2O2(g) = CO(g) ![]() H= 110.0 kJ/mol
H= 110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式_____________________。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol,H2O(l)= H2O(g) △H= +44.0 kJ/mol,则反应CH4(g)+ H2O(g) ![]() CO(g)+3H2(g)△H=______________。
CO(g)+3H2(g)△H=______________。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJ/mo1
CH3OH(g)△H=-91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是_____________。
A.2mo1 CO和4mol H2 B.2mo1 CO、4mol H2和1mol CH3OH(g)
C.4mo1 CO和4mol H2 D.4mo1 CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,反应达到平衡时的热量变化是___(填“吸收”或“放出”)___kJ热量。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则 ΔH2=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇具有紫丁香味,其酯类常用于香精调制。下图为松油醇的结构,以下关于它的说法正确的是
![]()
A. 分子式为C10H19O
B. 同分异构体可能属于醛类、酮类或酚类
C. 与氢气加成后的产物有4种一氯代物
D. 能发生取代、氧化、还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
反应装置或图像 | 实验现象或图像信息 | |
A |
| 反应开始后,针筒活塞向右移动 |
B |
| 反应物总能量大于生成物总能量 |
C |
| 反应开始后,甲处液面低于乙处液面 |
D |
| 温度计的水银柱不断上升 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组粒子,属于同种核素的是_____(填编号,下同),互为同位素的是______,互为同素异形体的是_____,属于同种物质的是_________。
①16O2和18O3②16O2和18O2③ H、D、T ④![]() 和
和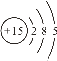 (核内15个中子)
(核内15个中子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用粗制ZnO粉末(含杂质Fe、Ni等)制备高纯ZnO的流程如下:
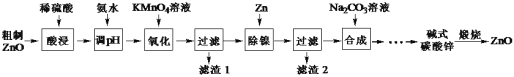
已知:本实验条件下,Ni2+不能被氧化,高锰酸钾还原产物为MnO2
(1)加快酸浸速率可采取的措施______。(任举一条)
(2)调pH约为5,再加KMnO4溶液进行氧化。写出“氧化”步骤对应的离子方程式______。
(3)“滤渣2”的成分是______。
(4)流程中“![]() ”涉及的操作有______、洗涤、______。
”涉及的操作有______、洗涤、______。
(5)获得的碱式碳酸锌需要用水洗涤,检验沉淀是否洗涤干净的方法是_____。
(6)已知Ksp[Fe(OH)3]=2.6×10-39。 25℃时,调节某酸性废水的pH值,使溶液中的Fe3+残留浓度为2.6×10-6molL-1,则pH应调至______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
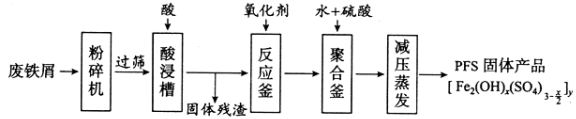
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com