
| A、1 mol-CH3和1 mol OH-都含有10 NA个电子 |
| B、常温常压下,8gCH4含有2NA个共价键 |
| C、1L 0.1 mol?L-1的醋酸溶液中含有0.1NA个H+ |
| D、标准状况下22.4 L 乙醇含碳原子数为NA |
 )分子中含有4个碳氢共价键;
)分子中含有4个碳氢共价键; ,0.5mol甲烷中含有2mol碳氢键,含有的共价键数约为2NA,故B正确;
,0.5mol甲烷中含有2mol碳氢键,含有的共价键数约为2NA,故B正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 |
| B、石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
| C、向汽油中添加甲醇后,该混合燃料的热值不变 |
| D、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移电子个数为2moL |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、某无色溶液中通入Cl2,溶液变为棕黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1g氢气中所含有的分子数为NA |
| B、0.5mol/L的AlCl3溶液中含有氯离子数为1.5NA |
| C、27g铝与足量NaOH反应消耗OH-的数目为4NA |
| D、7.8g的Na2O2与水完全反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式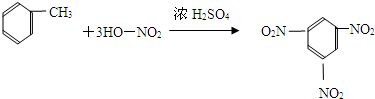 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水加热到很高的温度都难分解是因为水分子中存在氢键 |
| B、蔗糖、淀粉、蛋白质及其水解产物均为非电解质 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、不用任何试剂即可鉴别Na2CO3溶液和NaHSO4溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量暗红色固体样品放在试管中,加入足量的锡氨水,震荡、静置 | ② | 假设3成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com