
| A. | 3种溶液pH的大小顺序是①<②<③ | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是③ | |
| C. | 若分别加入25mL0.1 mol•L-1盐酸后,pH最大的是② | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
分析 A.碱溶液pH最大,盐溶液中,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大;
B.稀释相同的倍数,促进含有弱离子盐的水解,pH变化最大的是强碱;
C.碳酸氢钠溶液呈碱性,醋酸溶液呈酸性;
D.pH相等的这三种溶液,强碱的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小.
解答 解:A.碱溶液pH最大,盐溶液中,酸根离子水解程度越大,其相同浓度的钠盐溶液pH越大,醋酸根离子水解程度小于碳酸根离子,所以这三种溶液pH大小顺序是:①>②>③,故A错误;
B.稀释相同的倍数,促进含有弱离子盐的水解,强碱完全电离,所以pH变化最大的是强碱①,故B错误;
C.若分别加入相同物质的量的HCl,HCl和NaOH恰好完全反应生成NaCl,溶液呈中性,碳酸钠和HCl恰好完全反应生成碳酸氢钠和氯化钠,溶液呈碱性,和醋酸钠恰好完全反应生成氯化钠和醋酸,溶液呈酸性,所以pH最大的是②,故C正确;
D.pH相等的这三种溶液,强碱的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小,醋酸根离子水解程度小于碳酸根离子,所以若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>②>①,故D错误;
故选C.
点评 本题考查了pH的简单计算、盐类水解等知识点,明确弱酸根离子的水解程度与酸的酸性强弱的关系是解本题关键,再结合物质的性质分析解答,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | ClO-做还原剂 | B. | Fe(OH)3在反应中被还原 | ||
| C. | 高铁酸钾中铁的化合价为+7 | D. | 制备1molK2FeO4时转移3 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2LN2中含电子总数为5NA | |
| B. | 标准状况下,22.4LN2H4中所含原子总数为6NA | |
| C. | 标准状况下,3.2gN2H4中含有共价键的总数为0.6NA | |
| D. | 若生成3.6gH2O,则上述反应转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
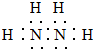 ,其中氮的化合价为-2;
,其中氮的化合价为-2;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| B. | 纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 | |
| C. | 已知工业合成氨△H<O,达平衡后,升高温度,正反应速率减少、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | NH3(g)+HCl(g)═NH4Cl(s)较低温下能自发进行,说明该反应的△H<O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶盖,冒出大量气泡 | |
| B. | 实验室常用排饱和食盐水法收集Cl2 | |
| C. | 平衡体系2NO2?N2O4△H<0,升高温度,颜色变深 | |
| D. | 平衡体系H2(g)+I2(g)?2HI(g),缩小体积,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混凝法,用明矾做混凝剂:Al3++3H2O?Al(OH)3+3H+ | |
| B. | 中和法,用过量CO2中和碱性废水:CO2+2OH-═CO32- | |
| C. | 沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ | |
| D. | 氧化还原法,用FeSO4将酸性废水中Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com