
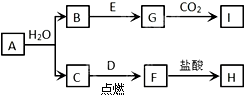


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| P |
| P0 |
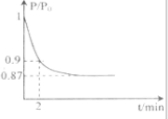
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图所示的装置中进行中和反应的反应热测定,实验操作如下:
在如图所示的装置中进行中和反应的反应热测定,实验操作如下:| 起始温度T1/(℃) | 终止温度T2/(℃) | 温度差 T2-T1 /(℃) | |||
| HCl | NaOH | 平均值 | |||
| 1 | 20.5 | 20.7 | 24.1 | ||
| 2 | 20.4 | 20.6 | 23.8 | ||
| 3 | 20.6 | 20.4 | 23.9 | ||
| 平 均 值 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
| A、平衡时,其他条件不变,增加M的浓度,N的转化率减小 |
| B、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| C、单位时间内消耗N和Q的物质的量比为1:1时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,N和P的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com