
科目:高中化学 来源:不详 题型:单选题
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量大 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解池的阳极生成双氧水,阴极生成臭氧 |
| B.电解池中硫酸溶液的pH保持不变 |
| C.产生臭氧的电极反应式为3H2O-6e-===O3+6H+ |
| D.产生双氧水的电极反应式为2H2O-2e-===H2O2+2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KCl | B.NaOH | C.Na2SO4 | D.H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KIO3在阳极产生,阴极产物为H2 |
| B.可以用不锈钢棒作两个电极的材料 |
| C.产生IO3-离子的电极周围溶液pH增大 |
| D.溶液中阳离子向阳极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
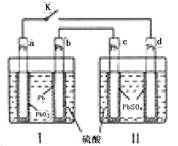
A.K 闭合时,d电极反应式: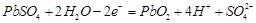 |
| B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol |
| C.K闭合时,II中SO42-向c电极迁移 |
| D.K闭合一段时间后,II可单独作为原电池,d电极为正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
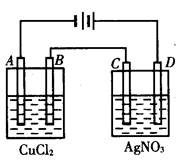
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
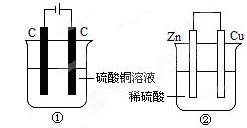
| A.产生气体体积 ①<② |
| B.①中阴极质量增加,②中正极质量减小 |
| C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑ ②中负极:2H++2e-=H2↑ |
| D.溶液的pH变化:①减小,②增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com