
顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化:
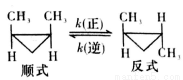
该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。
回答下列问题:
(1)已知:T1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1 =__________;该反应的活化能Ea (正)小于Ea (逆),则∆H_________0(填“小于”“等于”或“大于”)。
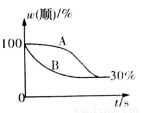
(2)T2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是___________(填曲线编号),平衡常数值K2 =__________;温度T2_________T1 (填“小于”“等于”或“大于”),判断理由是_______________。
科目:高中化学 来源:2017届江西省高三上学期第一次联考化学试卷(解析版) 题型:填空题
某班同学用如下实验探究Na2CO3、NaHCO3的性质。回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是______________。
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示:
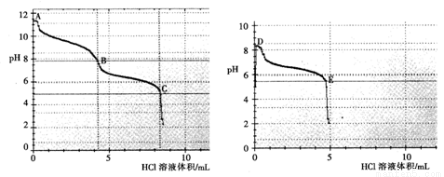
碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是__________(填A、B、C、D或E)。
B点的主要溶质是_____________(用化学式表示)。
③ B点__________(填“大于”或“小于”) D点的pH,主要原因是________________。
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上9月月考化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.漂白粉在溶液中存在平衡:ClO-+H2O HClO+OH-,加少量NaOH能提高其漂白效率
HClO+OH-,加少量NaOH能提高其漂白效率
B、硫酸钡难溶子水,但硫酸钡属于强电解质
C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大
D、物质的量浓度相同的四种溶液:①氯化铵②硫酸氢铵 ③次氯酸铵④碳酸铵的pH:④>②>①>③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上期初化学卷(解析版) 题型:选择题
下列说法正确的是
A.分子数不同的CO与N2的体积一定不等
B .体积相同的CO与N2的质量一定相等
.体积相同的CO与N2的质量一定相等
C.质量不同、密度相同的CO与N2所含分子数可能相同
D.质量相同、密度不同的CO与N2所含的原子数目一定相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上期初化学卷(解析版) 题型:选择题
气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少?③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第一次月考化学卷(解析版) 题型:选择题
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第一次月考化学卷(解析版) 题型:选择题
现将2mol气体A与1mol气体B充入一个体积不变的容器内,发生反应:2A+B C+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )
C+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )
A.上述反应达到平衡后,其他的条件不变的情况下,只改变压强,平衡不移动
B.该反应的化学平衡常数为
C.E为气体
D.该反应的热化学方程式2A(g)+B(g) C(g)+3D(l)+4E(g) △H=-QkJ/mol
C(g)+3D(l)+4E(g) △H=-QkJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上第一次考试化学卷(解析版) 题型:选择题
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量小
C.气体摩尔体积:甲<乙 D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上10月月考化学试卷(解析版) 题型:填空题
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中最高;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F的原子的M层电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 。
(4)E的最高价氧化物分子的空间构型是 ,其中心原子的杂化方式为 。
(5)F的高价离子与A的简单氢化物形成的配离子,不考虑空间构型,配离子的结构可用示意图表示为 。

(6)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm,该晶胞的密度为 g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com