
【题目】已知A2![]() 可将B2-氧化为B单质,
可将B2-氧化为B单质,![]() 则被还原为A3+,又知100 mL的0.3 mol·L-1的
则被还原为A3+,又知100 mL的0.3 mol·L-1的![]() 与150 mL的0.6 mol·L-1B2-恰好完全反应,则
与150 mL的0.6 mol·L-1B2-恰好完全反应,则![]() 中的n值为( )
中的n值为( )
A.4B.5C.6D.7
科目:高中化学 来源: 题型:
【题目】实验室里用乙醇和浓硫酸反应制取乙烯,接着再用溴与之反应生成1,2—二溴乙烷。在制备过程中由于部分乙醇被浓硫酸氧化还会生成CO2、SO2,进而与Br2反应生成HBr等。
(1)以上述三种物质为原料,用下列仪器(短接口或橡皮管均已略去)制备1,2-二溴乙烷。
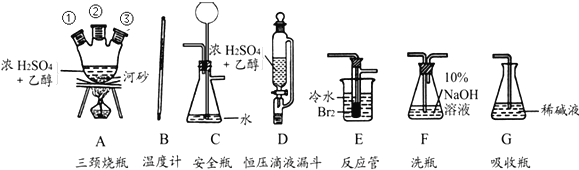
如果气体流向为从左到右,正确的连接顺序是:B经A①插入A中,D接A②;A③接______接_______接______接______。
(2)温度计水银球的正确位置是______。
(3)F的作用是______,G的作用是______。
(4)在三颈烧瓶A中的主要反应的化学方程式为______。
(5)在反应管E中进行的主要反应的化学方程式为______。
(6)反应管E中加入少量水及把反应管E置于盛有冷水的小烧杯中是因为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,同体积的氨气(![]() )和硫化氢气体(
)和硫化氢气体(![]() )的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
)的质量比为_________;同质量的氨和硫化氢气体的体积比为___________;若二者氢原子数相等,则它们的体积比为___________。(均为前者比后者)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是

A. 质子透过阳离子交换膜由右向左移动
B. 电子流动方向为N→Y→X→M
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂和产物略去):

已知:

(1)A的化学名称是_,E的核磁共振氢谱为三组峰,且峰面积之比为 3∶2∶1,E能发生水解反应,则 F 的结构简式为_。
(2)G 分子中所含官能团名称为_,羧酸 X 的实验式为_。
(3)B→C 所需的试剂 Y 和反应条件分别为_,由 F 到 G的反应类型为_。
(4)D 和 G 反应生成光刻胶的化学方程式为_____________________________________。
(5)C 的一种同分异构体满足下列条件:①能发生银镜反应,其水解产物之一能与 FeCl3溶液发生显色反应;②苯环上的一氯取代产物只有两种,该同分异构体的结构简式为__________________。
(6)根据已有知识并结合相关信息,写出以 CH3CHO 为原料制备 CH3COCOCOOH的合成路线流程图(无机试剂任选):________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾在南充求学和工作过的青年学者孙旭平及其领衔团队,近日成功利用Mo2N纳米催化剂在0.1mol·L1盐酸溶液中进行电催化固氮,装置如图所示,在一定电压下具有较高的产氨速率。下列判断错误的是

A. Mo2N/GCE电极为阴极
B. 溶液中H+通过隔膜向MoN/GCE电极区迁移
C. Mo2N/GCE电极区反应式为N2+6H++6e====2NH3
D. 为提高溶液的导电性,可在石墨电极区加入适量的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.糖类和油脂都是高分子化合物
B.蔗糖和麦芽糖互为同分异构体
C.葡萄糖和果糖互为同系物
D.纤维素可以被人体吸收,并释放能量供人体生命活动需要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com