
��16�֣���ҵ�����÷���м�����������������������ȣ���������������Һ���������Ʊ��̷�(FeSO4��7H2O)����������泥�(NH4)2SO4��FeSO4��6H2O��(�׳�Ī����)����Ҫ�Լ�����������������Һ�Ĺ����������£�
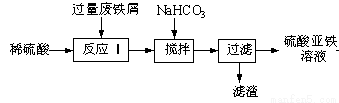
�ش��������⣺
��1����������NaHCO3��������ҺpH��Ŀ����__________________________��
��2������������Һ�ڿ����о������ױ��ʣ������ӷ���ʽ��ʾ����ʵ�ԭ��_____��
��3����������FeSO4��Һ�м�������3 moL? L-1 H2SO4��Һ���ټ��뱥��(NH4)2SO4��Һ����������Ũ������ȴ�ᾧ�����˵�һϵ�в�����õ���������茶����(NH4)2SO4��FeSO4��6H2O��(�׳�Ī����)����������什��̷��ȶ�����������ԭ�ζ������г���������Fe2+�ı���Һ����ȡ0.352g Cu2S��CuS�Ļ������������Һ����40.00 mL0.150 mol?L-1 KMnO4��Һ������������Ӧ���£�
8MnO4����5Cu2S��44H����10Cu2����5SO2����8Mn2����22H2O
6MnO4����5CuS��28H����5Cu2����5SO2����6Mn2����14H2O
��Ӧ�������Һ��ʣ���KMnO4ǡ����50.00mL 0.200 mol?L-1 (NH4)2Fe(SO4)2��Һ��ȫ��Ӧ��
����ƽ���ӷ���ʽ�� MnO4���� Fe2���� H������ Mn2���� Fe3+�� H2O
��Cu2S��CuS�Ļ������������Һ����0.150 mol?L-1 KMnO4��Һ��������Һ����е�ԭ���ǣ�_______________________________________________��
��ʵ��������500mL 3 moL? L-1 H2SO4��Һ����Ҫ��������Ϊ98%���ܶ�Ϊ1.84g? mL-1��������Ϊ__________ mL��������1λС����
���Լ���������CuS������������д��������̣���
��1����ȥ�����ӣ�����ʹ���������γɳ�����2�֣�����2��4Fe2+ + O2 + 4H+ =4Fe3+ + 2H2O ��2�֣�
��3����1��5��8��1��5��4��2�֣�
��������иϾ�SO2 ����Һ�е�SO2������KMnO4��Һ��Ӧ����ȷ�ⶨ�������CuS��������������2�֣���81.5 ��2�֣�
��54.5% ��6�֣�
��������
������������������������������ȵķ���м�м���������ϡ���ᣬ������Ӧ��Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O��Fe2O3+3H2SO4=Fe2(SO4)3+3H2O��Fe+ H2SO4= FeSO4+H2����Fe2(SO4)3+ Fe= 3FeSO4����1���ڷ�Ӧ�����Һ�к���FeSO4��Al2(SO4)3�������м�������NaHCO3��������ҺpH��Ŀ���dz�ȥAl3+��Fe2+��Ȼ�����ӵ���ʽ��������Һ�У���2������������Һ�ڿ����о������ױ��ʣ�����ΪFe2+�������е���������ΪFe3+.�����ӷ���ʽ��ʾ��4Fe2+ + O2 + 4H+ =4Fe3+ + 2H2O����3���ٸ��ݵ����غ㡢����غ㼰ԭ���غ�ɵ���ƽ���ӷ���ʽ�ǣ� MnO4����5Fe2����8H��=Mn2����5Fe3+��4H2O����Cu2S��CuS�Ļ������������Һ����0.150 mol?L-1 KMnO4��Һ������Ӧ������SO2���ܴ�������Һ�У�������иϾ�SO2 ����Һ�е�SO2������KMnO4��Һ��Ӧ����ȷ�ⶨ�������CuS����������������������Ϊ98%���ܶ�Ϊ1.84g? mL-1��������ʵ���Ũ����C=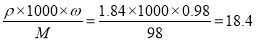 (mol/L)������Һ��ϡ���������ʵ����ʵ������䣬���Ը���ϡ��ʽC1?V1=C2?V2����ʵ��������500mL 3 moL? L-1 H2SO4��Һ����Ҫ��������Ϊ98%���ܶ�Ϊ1.84g? mL-1��������Ϊ(500mL ��3 moL/L)��18.4mol/L=81.5ml���ܵ����غ��� MnO4���� 5Fe2����ʣ���KMnO4�����ʵ���Ϊ��50.00��10��3L ��0.2 mol?L-1 ��1/5 = 2.00��10��3 mol��0.352g Cu2S��CuS�Ļ���ﷴӦ��KMnO4�����ʵ���Ϊ��40 mL��10��3L ��0.150 mol?L-1 �� 2.00��10��3 mol = 4.00��10��3 mol���裺Cu2S��CuS�Ļ�����У�Cu2S�����ʵ���Ϊx��CuS�����ʵ���Ϊy����ɵ÷��̢�160g/mmol x + 96 g/mmoly = 0.352g ���� 8/5 x +6/5y = 4.00��10��3 mol�����x = 1.00��10��3 mol��y = 2.00��10��3 mol�����Ի������CuS����������Ϊ��m(CuS)/m(��) = (2.00��10��3 mol��96 g/mol)/ 0. 352g = 54.5%
(mol/L)������Һ��ϡ���������ʵ����ʵ������䣬���Ը���ϡ��ʽC1?V1=C2?V2����ʵ��������500mL 3 moL? L-1 H2SO4��Һ����Ҫ��������Ϊ98%���ܶ�Ϊ1.84g? mL-1��������Ϊ(500mL ��3 moL/L)��18.4mol/L=81.5ml���ܵ����غ��� MnO4���� 5Fe2����ʣ���KMnO4�����ʵ���Ϊ��50.00��10��3L ��0.2 mol?L-1 ��1/5 = 2.00��10��3 mol��0.352g Cu2S��CuS�Ļ���ﷴӦ��KMnO4�����ʵ���Ϊ��40 mL��10��3L ��0.150 mol?L-1 �� 2.00��10��3 mol = 4.00��10��3 mol���裺Cu2S��CuS�Ļ�����У�Cu2S�����ʵ���Ϊx��CuS�����ʵ���Ϊy����ɵ÷��̢�160g/mmol x + 96 g/mmoly = 0.352g ���� 8/5 x +6/5y = 4.00��10��3 mol�����x = 1.00��10��3 mol��y = 2.00��10��3 mol�����Ի������CuS����������Ϊ��m(CuS)/m(��) = (2.00��10��3 mol��96 g/mol)/ 0. 352g = 54.5%
���㣺���黯ѧ������Ŀ�ġ����ӷ���ʽ����д����ƽ����Һ��ϡ�͡���ϵʽ�����غ㷨�ڹ��ڷ���ʽ�����Ӧ�õ�֪ʶ��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ɹŰ��и߶�10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ���¶Ⱥ�ѹǿ�Է�ӦX��Y 2ZӰ���ʾ��ͼ������������ȷ����
2ZӰ���ʾ��ͼ������������ȷ����
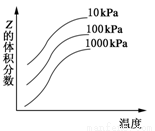
A���÷�ӦΪ���ȷ�Ӧ
B������ѹǿ��ƽ�������ƶ�
C��X��Y��Z��Ϊ��̬
D��X��Y�����ܶ�Ϊ��̬��ZΪ��̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤��������ֵ������������ȷ����
A��1mol�ǻ���17gNH3������������ΪNA
B��12��4g���ף�����ʽΪP4���к���P��P���ۼ�0��6NA
C�����³�ѹ�£�Na2O2������H2O��Ӧ��������0��2molO2��ת�Ƶ��ӵ���ĿΪ0��8 NA
D������ͭ���ܽ���1L0��5mol��L��1ϡ�����У�������2��24LNOʱ����Һ�е�ԭ����Ϊ0��4 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡΫ���и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
YBa2Cu8Ox(YΪԪ����)��һ����Ҫ�������ϣ����й��� Y��˵���������
Y��˵���������
A�����ڽ���Ԫ��
B����������������֮��Ϊ50
C��ԭ�ӵĺ����������39
D�� Y ��
Y �� Y �����ֲ�ͬ�ĺ���
Y �����ֲ�ͬ�ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡΫ���и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
A���κλ�ѧ��Ӧ�������������仯
B���������Һ�ĵ�����̾��ǵ��Ĺ���
C�����ǡ����ᱵ��ˮ�ֱ����ڷǵ���ʡ�ǿ����ʺ��������
D���������Һ�ı����������ܷ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�γ��и����ڶ��ε��п��Ի�ѧ�Ծ��������棩 ���ͣ������
��12�֣���������Ҫ�Ļ���ԭ�ϡ�
��1����������ˮ�õ���ˮ����ˮ�д������з�Ӧ��Cl2 + H2O H��+Cl��+ HClO����ƽ�ⳣ������ʽΪK�� ��
H��+Cl��+ HClO����ƽ�ⳣ������ʽΪK�� ��
��2����ҵ�ϳ�����ʯ�Һ�������Ӧ��ȡƯ�ۣ���ѧ��Ӧ����ʽ�� ����������ͼ��ʾ������Ҫ�豸���Ȼ����������ϵ��·��IJ㡣

������3%��6%ˮ�ֵ���ʯ�Ҵ������������룬������������ײ�ͨ�롣�������ϵ�Ŀ���� ���������Ȼ������ݳ�������Լ�Ϊ ��
��3��ij����С����ʵ�����ý�Ũ��KOH��Һֱ�������������о����ַ�Ӧ����һ��ʱ���ʼ����KClO3�������࣬����KClO3�����ӷ���ʽ�� ����ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�γ��и����ڶ��ε��п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ���ҿ���NaNO2+NH4Cl ==NaCl+N2��+2H2O�Ʊ�N2������˵����ȷ����
A��NaNO2����������Ӧ
B��NH4Cl�еĵ�Ԫ�ر���ԭ
C��N2��������������ǻ�ԭ����
D��ÿ����1mol N2ת�Ƶ��ӵ����ʵ���Ϊ6mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�����и������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�鷽���У����ܴﵽʵ��Ŀ����
ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
A | ��֤Ksp(AgCl)��Ksp(AgI) | ��NaCl��Һ�еμ�AgNO3��Һ��������ɫ�������ٵμ�KI��Һ���ɹ۲쵽��ɫ����ת��Ϊ��ɫ���� |
B | ����Fe(NO3)2�����Ƿ����������� | ��Fe(NO3)2��Ʒ����ϡH2SO4�μ�KSCN��Һ���۲���Һ�Ƿ��� |
C | ��֤Br2��������ǿ��I2 | ��������ˮ����KI��Һ�У��ټ���CCl4�������á��ɹ۲쵽�²�Һ�����ɫ |
D | �Ƚ�ȷ��ͭ��þ�Ľ������ǿ�� | ��ʯī���缫���Mg(NO3)2��Cu(NO3)2�Ļ��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ���Ƹ��и�����ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڸ�������������£�9.2 g����þ����������ܽ���һ����ijŨ�ȵ�ϡ�����У���������ȫ�ܽ���ռ���4.48 L����״���£�NO���塣�ڷ�Ӧ�����Һ�м����������ռ���Һ�������������������������Ϊ
A��18.6 g B��20 g C��19.4 g D��24 g
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com