
【题目】下列条件下,两瓶气体所含原子数一定相等的是![]()
![]()
A. 同质量的![]() 和
和![]() B. 同质量的
B. 同质量的![]() 和
和![]()
C. 同体积的![]() 和
和![]() D. 相同物质的量的
D. 相同物质的量的![]() 和
和![]()
【答案】D
【解析】A项,等质量的N2和CO2的物质的量之比为11:7,所含原子物质的量之比为22:21;B项,等质量的H2和N2的物质的量之比为14:1,所含原子物质的量之比为14:1;C项,O2和N2所处的温度、压强未知,无法确定同体积的O2和N2物质的量的大小;D项,相同物质的量的N2O和CO2含原子物质的量相等。
A项,N2和CO2的摩尔质量之比为28:44=7:11,等质量的N2和CO2的物质的量之比为11:7,所含原子物质的量之比为22:21,A项所含原子数不相等;B项,H2和N2的摩尔质量之比为2:28=1:14,等质量的H2和N2的物质的量之比为14:1,所含原子物质的量之比为14:1,B项所含原子数不相等;C项,O2和N2所处的温度、压强未知,无法确定同体积的O2和N2物质的量的大小,C项所含原子数不一定相等;D项,N2O和CO2都是三原子分子,相同物质的量的N2O和CO2含原子物质的量相等,D项所含原子数一定相等;答案选D。


科目:高中化学 来源: 题型:
【题目】有一混合溶液,只可能含有以下离子中的若干种:K+、![]() 、Cl-、Mg2+、Ba2+、
、Cl-、Mg2+、Ba2+、![]() 、
、![]() ,现取三份100 mL该溶液进行如下实验:
,现取三份100 mL该溶液进行如下实验:
(1)向第一份溶液中加入AgNO3溶液时有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液并加热后,收集到气体0.06 mol;
(3)向第三份溶液中加入足量BaCl2溶液后,所得沉淀经洗涤、干燥、称量为8.24 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。
根据上述实验,以下推测正确的是( )
A. K+可能存在 B. 100 mL溶液中含0.01 mol ![]()
C. Cl可能存在 D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
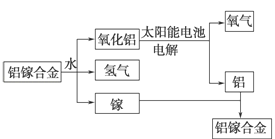
A. 该过程中,能量的转化形式只有两种
B. 铝镓合金可以循环使用
C. 铝镓合金与水反应的化学方程式为:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
D. 总反应式为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+2ICl(g)![]() I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
I2(g)+2HCl(g),该反应分①、②两步进行,其能量曲线如图所示,
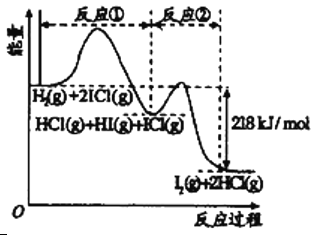
下列有关说法正确的是
A. 反应①为吸热反应
B. 反应①和②均是同种元素间发生的氧化还原反应
C. 反应①比反应②的速率慢,与图中相应峰高有关
D. HI(g)+ICl(g) ![]() I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
I2(g)+HCl(g)生成1摩尔HCl放出218kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
![]()
A. 气体摩尔体积就是![]()
B. 非标准状况下,1mol任何气体的体积不可能为![]()
C. 标准状况下![]() 任何物质都含有约
任何物质都含有约![]() 个分子
个分子
D. ![]() 和
和![]() 的混合气体在标准状况下的体积约
的混合气体在标准状况下的体积约![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是

A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】180℃时将0.5 mol H2和1 mol CO2通入2 L的恒容密闭容器中,此时容器内总压强为P0(已知分压=总压×物质的量分数),反应生成甲醇蒸汽(CH3OH)和H2O,测得各物质的物质的量随时间的部分变化如图所示,回答下列问题:
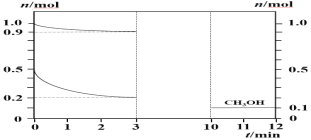
(1)该反应的化学方程式为:___________________
(2)在0~3 min内H2的平均化学反应速率为___________________
(3)0-1分钟的速率为V1,2-3分钟的速率为V2,10-11分钟的速率为V3,则V1、V2、V3由大到小的顺序为____________________________。
(4)3min内H2的转化率为______。
(5)平衡时,容器内的压强为__________,CO2的分压为____________(均保留2位有效数字)
(6)以(1)中反应设计成原电池(用硫酸作电解质溶液),则正极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业上产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉CO2”,其基本过程如图所示(部分条件及物质未标出)
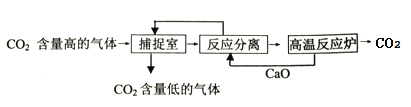
下列有关该方法的叙述中正确的是
A. 能耗小是该方法的一大优点
B. 整个过程中,只有一种物质可以循环利用
C. “反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
D. 该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 27 g铝中加入1 mol·L-1的NaOH溶液,转移电子数是3NA
B. 标准状况下,33.6 L HF中含有氟原子的数目为1.5NA
C. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA
D. 25 ℃,pH=7的NH4Cl和NH3·H2O的混合溶液中,含OH-的数目为10-7NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com