
����Ŀ��(1)ʪ���Ƹ��������(K2FeO4)�ķ�Ӧ��ϵ�����������ӣ�Fe(OH)3��ClO����OH����FeO42����Cl����H2O��
��д������ƽʪ���Ƹ�����ط�Ӧ�����ӷ���ʽ��______________________________
��ÿ����l mol FeO42-ת��__________mol���ӣ�����Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ____mol��
�۵����£��ڸ���������Һ�м���KOH�����Ϳ������������(K2FeO4)ԭ����__��
(2)��ҵ�ϴӺ�ˮ����ȡ������ɲ������·�����
����ˮ��ͨ��Cl2����ˮ���廯�������������ӷ���ʽΪ____��
�����������Һ�д����ȿ����������ɵ��崵�����ô�����Һ���գ��仯ѧ����ʽΪ__��
�۽���������Һ��H2SO4�ữ��ʹNaBr��NaBrO3�е���ת��Ϊ�����壬�����л��ܼ���ȡ����ɵõ�����ƷNa2SO4����һ���̿��û�ѧ����ʽ��ʾΪ____��
���𰸡�2Fe(OH)3��3ClO����4OH��===2FeO42����3Cl����5H2O 3 0.15 ���¶���K2FeO4��Na2FeO4���ܽ��С Cl2��2Br��===Br2��2Cl�� 3Na2CO3��3Br2===5NaBr��NaBrO3��3CO2��6Na2CO3��3Br2��3H2O===5NaBr��NaBrO3��6NaHCO3 5NaBr��NaBrO3��3H2SO4===3Br2��3Na2SO4��3H2O
��������
(1)��ʪ���Ʊ��������(K2FeO4)����FeO42-Ϊ���Fe(OH)3Ϊ��Ӧ����ϼ������ܹ�3�ۣ��ɵ���ת���غ��֪��ClO-Ϊ��Ӧ�Cl-Ϊ��������ϼ۽���2�������ϼ�������С������Ϊ6����Fe(OH)3��ϵ��Ϊ2��FeO42-��ϵ��Ϊ2��ClO-��ϵ��Ϊ3��Cl-��ϵ��Ϊ3�����ݵ���غ��֪��OH-Ϊ��Ӧ�ϵ��Ϊ4����Ԫ���غ��֪H2OΪ�������ϵ��Ϊ5�����ӷ���ʽΪ��2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O���ʴ�Ϊ��2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O��
�ڷ�Ӧ��FeԪ�ػ��ϼ۱仯��+3������Ϊ+6����ÿ����1mol FeO42-ת�Ƶ��ӣ�1mol��(6-3)=3mol����ԭ����ΪCl-������Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ![]() =0.15mol���ʴ�Ϊ��3��0.15��
=0.15mol���ʴ�Ϊ��3��0.15��
�۸��¶��£�K2FeO4���ܽ�ȱ�Na2FeO4���ܽ�ȸ�С���ڸ���������Һ�м���KOH�����Ϳ������������(K2FeO4)���ʴ�Ϊ�����¶��£�K2FeO4���ܽ�ȱ�Na2FeO4���ܽ�ȸ�С��
(2)��ͨ�������������������ӷ�Ӧ���ɵ�����������ӣ������ӷ���ʽΪ��Cl2+2Br-�T2Cl-+Br2���ʴ�Ϊ��Cl2+2Br-�T2 Cl-+Br2��
�ڴ�����Һ����Br2�Ļ�ѧ����ʽΪ��3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2����6Na2CO3��3Br2��3H2O=5NaBr��NaBrO3��6NaHCO3���ʴ�Ϊ��3Na2CO3+3Br2=5NaBr+NaBrO3+3CO2����6Na2CO3��3Br2��3H2O=5NaBr��NaBrO3��6NaHCO3��
�۽���������Һ��H2SO4�ữ��ʹNaBr��NaBrO3�е���ת��Ϊ������������ƣ��������������Ԫ�ػ��ϼ�Ϊ+5�۱��0�ۣ����ϼ۽���5�ۣ������ӻ��ϼ���-1�۵�0�ۣ����ϼ�����1�ۣ��ϼ۱仯����С������Ϊ5��������������Ӽ�����Ϊ1�������Ӽ�����Ϊ5���ٸ��ݹ۲취��ƽ����ƽ��Ӧ�Ļ�ѧ����ʽΪ��5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br 2+3H2O���ʴ�Ϊ��5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br 2+3H2O��


 һ����������ϵ�д�
һ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʿ����ڳ˳�������ɻ�ʱ�ϴ�������Я������(����)
A. Ũ���� B. ������� C. ��� D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1 mol����������2 mol̼�����ƹ����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʺ���ȴ�������Ĺ���������( )
A. Na2CO3 B. Na2O2��Na2CO3
C. NaOH��Na2CO3 D. Na2O2��NaOH��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.pH=6�Ľ���������
B.����й©��Ӧ˳����ʹ���
C.�ѱ���FeCl3��Һ�μӵ�NaOH��Һ�У������Ʊ�Fe(OH)3����
D.�ҹ����л����еĴ�����Ⱦ����Ҫ��SO2��NO2��CO��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ����� ������������ȷ����(����)
������������ȷ����(����)
A. ���Ӽ���γ���� B. �����м��м��Լ����зǼ��Լ�
C. ��������7��������1������ D. �÷�����ˮ�е��ܽ��С��2��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ǵӻƻ�������ȡ��һ����ɫ��״���壬˫���������������ص���Ҫ�������ű����Ч���������أ���ش��������⣺
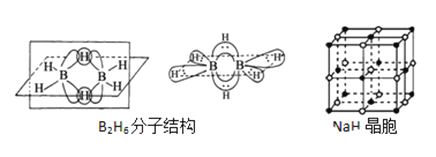
��1����������ص�����Ԫ�ص縺���ɴ�С������__________��������̬Oԭ�ӵļ۵����Ų�ͼ__________��
��2��һ�������ط����к���_______������̼ԭ�ӡ�
��3��˫�������صĺϳ�һ���������⻯��(NaBH4)��ԭ�����أ����⻯��ĺϳɷ����У� 2LiH+B2H6=2LiBH4�� 4NaH+BF3�TNaBH4+3NaF
��д��BH4���ĵȵ�����_________�����ӡ����Ӹ�дһ�֣���
��B2H6���ӽṹ��ͼ��2��Bԭ�Ӻ�һ��Hԭ�ӹ���2�������γ�3���Ķ����Ӽ����м��2����ԭ�ӱ���Ϊ������ԭ����������������2��Bԭ�ӣ���B2H6��������______�ֹ��ۼ���
��NaBH4����������һ��Bԭ�����γ�4�����ۼ���������ʯ(Na3AlF6)����������һ��Alԭ�ӿ����γ�6�����ۼ���ԭ����______________��
��NaH�ľ�����ͼ����NaH�����������ӵ���λ����_________���辧��������������Ϊ����������ǡ�����У������������ӵİ뾶��![]() =__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
=__________�ɴ˿�֪�������ӵİ뾶���Ǿ������Ӿ���ṹ����Ҫ���أ���Ƽ������أ�����֮��Ӱ�����Ӿ���ṹ�����ػ���_________��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10mL 0.1mol��L-1��BaCl2��Һǡ�ÿ�ʹ��ͬ�����������������п�������������Һ�е������������ȫת��Ϊ���ᱵ��������������������Һ�����ʵ���Ũ��֮����
A.1:3:3B.3:1:1C.3:2:2D.1:2:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����þ��ֲ���Ҷ����������������Ľ�������ʮ����Ҫ�����á���ش��������}��
��1�����־��������������ɿ��Ŀ�ѧ����Ϊ_________________��
��2��NaBH4��һ����Ҫ�Ĵ������壬�����ӽṹʽΪ______________��
��3��ͼ1��ʾ���������һ����������ʽ�ṹ���仯ѧʽ�ɱ�ʾΪ________________(��n��ʾ��ԭ�ӵĸ���)��
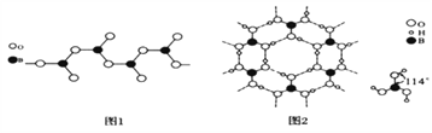
��4�����ᾧ����Ƭ��ṹ������ʯī���ƵIJ�״�ṹ��ͼ2��ʾ��������һ��Ľṹ�����ᾧ���д��ڵ��������й��ۼ���________��________����H3BO3������ӽ�����________(����ĸ)��
A��H4SiO4 B.H3PO4 C��HNO2
���ᾧ������ˮ���ܽ�Ⱥ�С��������ˮ�нϴ�ԭ����____________________��
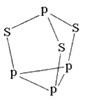
��5�����������ӣ���ͼ����_________���ӣ�����ԡ���Ǽ��ԣ�����NA��ʾ�����ӵ���������ֵ��0.1mol�����������к��еŵ��Ӷ���Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���£�ij�����ܶ���1.25g��L-1��һ������ĸ�����ȫȼ������4.48LCO2��3.6gˮ�������ķ���ʽ_________________��
��2���л���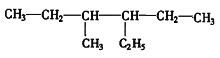 ����ȷ����Ϊ_______________________��
����ȷ����Ϊ_______________________��
��3��ij��lmol��2molHCl��ȫ�ӳɣ����ɵ��ȴ�������������6mol������Ӧ��������Ľṹ��ʽΪ_______________________��
��4����������������
�� ��
��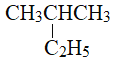 ������
������
�������� ��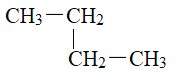 ��
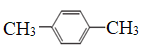
��
���л�Ϊͬ���칹�����__________________(�����)���ڢۢܢ��������ʰ����ǵķе��ɵ͵��ߵ�˳����_______________(�����)���������Ģ٢ۢ��������ʣ���ȫȼ��ʱ����O2�����ʵ������ٵ����˳��Ϊ________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com