
�����йع�ҵ������������ȷ���ǣ�
| A����⾫��ͭʱ��ͬһʱ���������ܽ�ͭ����������������ͭ������С |
| B�����Ṥҵ�У��ڽӴ��Ұ�װ�Ƚ�������Ϊ������SO3ת��ΪH2SO4ʱ�ų������� |
| C����ⱥ��ʳ��ˮ���ռ�������ӽ���Ĥ�����ɷ�ֹ�����Ҳ�����Cl2���������� |
| D���ϳɰ����������н�NH3Һ�����룬�ɼӿ�����Ӧ���ʣ����N2��H2��ת���� |
 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣 �ϳ����з�����ӦΪ�� N2(g)+3H2(g) ![]() 2NH3(g) ��H<0
2NH3(g) ��H<0
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO(g)+H2O(g) ![]() CO2(g)+H2(g) ��H>0
CO2(g)+H2(g) ��H>0
��t��ʱ����1L�ܱ������г���0.2mol CO��0.3molˮ��������Ӧ����ƽ���
��ϵ��c(H2)��0.12mol��L��1��
���¶��´˷�Ӧ��ƽ�ⳣ��K �� ��
�ڱ����¶Ȳ��䣬������ƽ����ϵ���ټ���0.1mol CO������Ӧ���½���ƽ��ʱ��
ˮ��������ת���ʦ� (H2O) ��
��2���±�Ϊ��ͬ�¶��ºϳɰ���Ӧ��ƽ�ⳣ�����ɱ�����֪T1 573K���>������<����=������
| T/K | T1 | 573 | T2 |
| K | 1.00��107 | 2.45��105 | 1.88��103 |
��3��673K��30MPa��n(NH3) ��n(H2) ��ʱ��仯
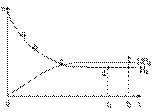 �Ĺ�ϵ����ͼ��ʾ������ͼ�������й���
�Ĺ�ϵ����ͼ��ʾ������ͼ�������й���
����ȷ���ǣ���д��ţ� ��
A��c���ʾn(NH3)��n (H2)���
B��c���ʾNH3����������NH3�ֽ�������ͬ
C��e���d��ʱ��Ӧ��ƽ�ⳣ����ͬ
D��c��ʱ����Ӧ���ʴ����淴Ӧ����
��4����NO2����ˮ�����3NO2+H2O![]() 2HNO3+NO�����������̿�������������
2HNO3+NO�����������̿�������������
Ҫ�����������ԭ���û�ѧƽ���ƶ������۽��н�����
��
��5�����᳧��β�����е��������������ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽��
����ȼ�������еļ���Ƚ��������ﻹԭΪ������ˮ���䷴Ӧ����Ϊ��
CH4(g)+4NO2(g)��4NO(g)+CO2(g)+2H2O(g)�� ��H����574kJ��mol��1
CH4(g)+4NO(g)��2N2(g)+CO2(g)+2H2O(g)�� ��H����1160kJ��mol��1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��
��
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
ks5u
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com