
 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL 1mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL 1mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题: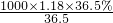 mol/L=11.8mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,令需要钠元素的体积为V,则:
mol/L=11.8mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,令需要钠元素的体积为V,则: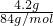 =0.05mol,令0.05mol碳酸氢钠完全反应需要HCl的物质的量为xmol,则:
=0.05mol,令0.05mol碳酸氢钠完全反应需要HCl的物质的量为xmol,则: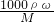 计算浓盐酸的物质的量浓度,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓盐酸的体积;
计算浓盐酸的物质的量浓度,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓盐酸的体积; 判断对溶液浓度的影响;
判断对溶液浓度的影响; 理解溶液配制原理.
理解溶液配制原理. 

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:阅读理解
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
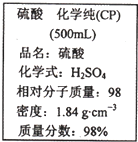 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A、该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | B、取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸 | C、配制200mL4.6 mol?L-1的稀硫酸需取该硫酸50mL | D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com