
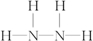 ,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol. 分析 A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E(双核18电子离子)的电子数少8,A、B、C、D四种离子均为10电子.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,则A为OH-,B为Na+、C为Al3+,甲为NaOH,乙为Al(OH)3;
(2)B与E结合成化合物丙,其中离子数之比为2:1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,则为E为O22-,丙为Na2O2,D为H3O+,丁为H2O;
(3)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7:1,分子中N、H原子数目之比为$\frac{7}{14}$:$\frac{1}{1}$=2:1,与E的电子数相同,则戊为N2H4.
解答 解:A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E(双核18电子离子)的电子数少8,A、B、C、D四种离子均为10电子.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,则A为OH-,B为Na+、C为Al3+,甲为NaOH,乙为Al(OH)3,Al在周期表中位置为:第三周期ⅢA族,乙与甲的水溶液反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:第三周期ⅢA族;Al(OH)3+OH-═AlO2-+2H2O;
(2)B与E结合成化合物丙,其中离子数之比为2:1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,则为E为O22-,丙为Na2O2,D为H3O+,丁为H2O,丁与丙反应的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(3)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7:1,分子中N、H原子数目之比为$\frac{7}{14}$:$\frac{1}{1}$=2:1,与E的电子数相同,则戊为N2H4,该分子结构中只有单键,与氨相似,则N原子之间形成1对共用电子对,N原子与H原子之间形成1对共用电子对,其结构式为: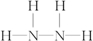 ,与足量盐酸反应离子方程式为:N2H4+2H+═N2H62+;
,与足量盐酸反应离子方程式为:N2H4+2H+═N2H62+;
N2H4中氮元素的化合价为-2价,既可以升高,又可以降低,既可作氧化剂,又可作还原剂;
液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,应生成氮气与水,8gN2H4的物质的量为$\frac{8g}{32g/mol}$=0.25mol,1molN2H4反应放出的热量为375kJ×$\frac{1mol}{0.25mol}$=1500kJ,反应热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol,
故答案为: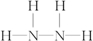 ;N2H4+2H+═N2H62+;N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
;N2H4+2H+═N2H62+;N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
点评 本题考查无机物推断,需要学生熟练掌握常见10电子、18电子微粒,熟练掌握常见元素化合物性质,难度中等.


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
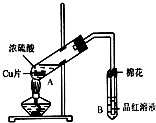 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | B. | 乙醇的分子式:C2H6O | ||
| C. | NH4Cl的电子式: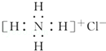 | D. | 羟基的电子式: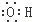 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醛能与氢气加成,而乙酸不能与氢气加成 | |
| C. | 乙醇能与金属钠反应,而甲醚不能与金属钠反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 次氯酸钠溶液与醋酸溶液混合:ClO-+H+═HClO | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
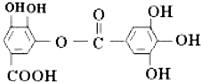
| A. | 与稀H2SO4共热,生成2种有机物 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com