
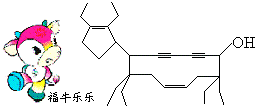
| A. | 牛式二烯炔醇含有4种官能团 | |
| B. | 牛式二烯炔醇不能使酸性KMnO4溶液褪色 | |
| C. | 1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应 | |
| D. | 该有机物的化学式为C29H44O |
科目:高中化学 来源: 题型:选择题
| A. | Cu→Cu(NO3)2 | B. | C→CO2 | C. | CuO→Cu(NO3)2 | D. | Fe2O3→Fe(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
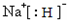 ,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃15mL、3mol•L-1的X溶液 | B. | 10℃30mL、1mol•L-1 的X溶液 | ||
| C. | 10℃30mL、2 mol•L-1 的X溶液 | D. | 10℃10mL、4mol•L-1 的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
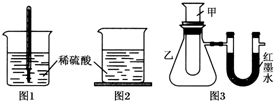
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、NO3- | B. | K+、Na+、Br-、SiO32- | ||
| C. | H+、Fe2+、SO42-、Cl2 | D. | K+、Ag+、NH3•H2O、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com