
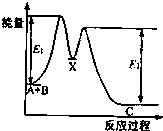
 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
分析 A、反应热△H=反应物的总能量-生成物的总能量;
B、反应吸放热取决于反应物和生成物的总能量的相对大小;
C、依据催化剂是先作为反应物参与化学反应、后被消耗来分析;
D、反应吸放热即及吸放热的多少取决于反应物和生成物的总能量的相对大小.
解答 解:A、由于反应热△H=反应物的总能量-生成物的总能量,故E2不是反应X→C的反应热,而是反应X→C的逆反应的活化能,故A错误;
B、依据图象分析可知反应物AB能量高于生成物C的能量,反应是放热反应,故B正确;
C、催化剂在反应中要先被消耗、后又生成,但X在反应A(g)+B(g)→C(g)中先生成、后消耗,故不是催化剂,只是中间产物,故C错误;
D、反应吸放热即及吸放热的多少取决于反应物和生成物的总能量的相对大小,与催化剂的使用无关,故D错误.
故选B.
点评 本题考查了反应的焓变意义图象分析应用,催化剂改变反应速率的过程,掌握基础是关键,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | N | B. | O | C. | Na | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 49 | C. | 48 | D. | 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该过程中CeO2没有消耗 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 如图中△H1=△H2+△H3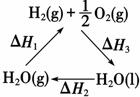 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
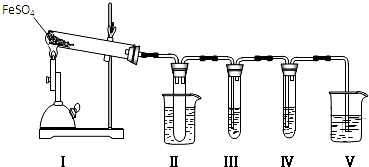
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5mol.L-1BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水). |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
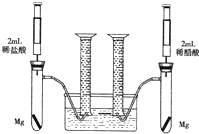 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
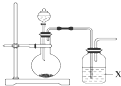 实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示
实验室可用浓硫酸和亚硫酸钠固体制备SO2,并验证其相关性质.装置如图所示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com