
分析 (1)根据甲醇的质量及反应放出的热量来计算燃烧热,然后来书写热化学方程式;
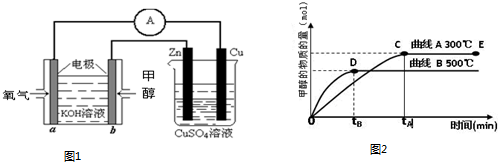
(2)①由甲醇的物质的量与反应温度的关系图可知温度越高甲醇的物质的量越低来判断水煤气合成甲醇的反应热;
②由容积压缩则压强增大,利用压强对化学反应速率及化学平衡的影响来分析;
③根据温度对化学平衡的影响来分析化学平衡常数的变化;
(3)由图可知甲醇燃料电池是电源,则烧杯中的装置为电解池,利用电解池和原电池来分析解答.
解答 解:(1)由1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则1mol甲醇燃烧放出的热量为32×22.68kJ=725.8 kJ,即燃烧热△H=-725.8 kJ•mol-1,由反应物与生成物、物质的状态、反应热,则甲醇燃烧的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-725.8 kJ•mol-1;
(2)①由图可知,500℃比300℃达平衡时甲醇的物质的量小,即升高温度化学平衡逆向移动,则正反应为放热反应,△H<0,故答案为:<;
②由其它条件不变,将E点的容积压缩到原来的1/2,则容积压缩时压强增大,加压时正、逆反应速率都加快,由水煤气合成甲醇的反应可知,该反应是气体体积缩小的反应,则加压时平衡正向移动,甲醇的物质的量增大,CO的物质的量减小,则c(CH3OH)/c(CO)增大,故答案为:加快;增大;
③由230℃时,平衡常数K=1,该反应为放热反应,温度升高到450℃时平衡向逆反应方向移动,生成物的浓度变小,则K<1,故答案为:<;
(3)由图可知,甲醇燃料电池中a极通入氧气,在碱性条件氧气得电子生成氢氧根离子,即通入氧气的为正极,正极反应为O2+4e-+2H2O-═4OH-,
b为电池的负极,后边的烧杯为电解池装置,锌与b相连,则锌极为阴极,故答案为:阴;O2+4e-+2H2O-═4OH-.
点评 本题考查知识点较多,综合性强,注重对基础知识和基本技能的考查,同时注重对高考热点的训练,明确热化学方程式、化学平衡、化学反应速率、电化学等重要知识点是解答的关键.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:2016-2017学年吉林省长春市高二上学期期初考试化学试卷 题型:填空题
现有下列8种物质:①Na2CO3、②NaHCO3、③HCl、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食盐水、⑧CH3COOH。
(1)上述物质中属于强电解质的是________(填序号),既能跟盐酸反应又能跟NaOH溶液反应的是____________(填序号)。(2)上述②的水溶液呈碱性的原因是(用离子方程式表示)______________________。(3)④与足量的NaOH浓溶液在加热条件下反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于K=$\frac{{c}^{2}(Z)}{{c}^{2}(X)•c(Y)}$,随着反应的进行,Z的浓度不断增大,X、Y的浓度不断减小,平衡常数不断增大 | |
| B. | 当温度不变时,增大反应物的浓度,使K变小;增大生成物的浓度,使K增大 | |
| C. | 增大压强,K值一定增大 | |
| D. | 温度发生变化时,上述的K 的值也发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L NaOH溶液 | B. | 0.5 mol/L盐酸 | ||
| C. | 0.5 mol/L NH4Cl溶液 | D. | 0.5 mol/L氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=12 | |
| B. | pH=2 | |
| C. | 由水电离产生的[H+]=1.0×10-2mol•L-1 | |
| D. | 溶质的物质的量浓度为0.01 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:21 | C. | 3:1 | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸在光照下变黄,说明浓硝酸不稳定,且生成的产物可溶于浓硝酸 | |
| B. | 向某溶液中加入氯化钡溶液和稀硝酸,有白色沉淀生成,说明该溶液中一定含有SO42- | |
| C. | 常温下,将铜放入浓硫酸中无明显变化,说明铜在冷浓硫酸中钝化 | |
| D. | 氯气使湿润的碘化钾淀粉试纸变蓝,说明氯气与淀粉反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L就是气体摩尔体积 | |
| B. | 标准状况下,22.4L任何物质都含有大约6.02×1023个分子 | |
| C. | 非标准状况下,1mol任何气体的体积不可能为22.4L | |
| D. | 1mol氢气和氧气的混合气体在标准状况下的体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com