
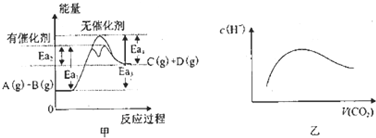
| A、由甲可知,A与B在有催化剂存在的热化学方程式为:A(g)+B(g)?C(g)+D(g)△H═+(Ea3-Ea4)KJ?mol-1 | ||||
B、常温常压下,将a mol CO2气体通入1L bmol/L的NaOH溶液中,当a=2b时,随着CO2气体的通入,溶液中由水电离出的c(H+)有如图乙变化关系;当
| ||||
| C、己知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液的浓度为5.6×10-5mol/L,则生成沉淀所需Na2CO3溶液的最小浓度为2×10-4mol/L | ||||
| D、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混台后(不考虑混台后溶液体积的变化)恰好完全反应,反应后的溶掖中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.05mol?L-1 |
| 1 |
| 2 |
| a |
| b |
| 1 |
| 2 |
| a |
| b |


科目:高中化学 来源: 题型:
| A、离子化合物中可能含共价键 |
| B、共价化合物中一定不含离子键 |
| C、所有物质中都含有化学键 |
| D、离子化合物中不一定含金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,9gH2O含有分子数为0.5NA |
| B、标准状况下,以任意比例混合的甲烷和丙烷(C3H8)的气体混合物11.2L,则所含有的分子数为NA |
| C、常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA |
| D、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都是碳氢化合物 |
| B、淀粉和蛋白质均可作为生产葡萄糖的原料 |
| C、石油裂化和油脂皂化都是高分子生成小分子的过程 |
| D、装饰材料中的甲醛和芳香烃会造成居室污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2、NO和O2 三者共存 |
| B、单位时间内生成2mol NO同时消耗2mol NO2 |
| C、v(NO2)正=2v(O2)逆 |
| D、容器中的各物质物质的量浓度之比为2:2:1的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量 436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量 243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量 431kJ |
| A、放热183kJ |
| B、放热91.5kJ |
| C、吸热183kJ |
| D、吸热91.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验及现象 | 理论解释 |
| A | 向等体积等浓度的Na2CO3和NaHCO3溶液中分别滴加酚酞溶液,前者溶液红色更深 | Na2CO3比NaHCO3的溶解度大 |
| B | 向等体积混合的AgCl与AgI的饱和溶液中滴加足量浓AgNO3溶液,生成沉淀AgI多于AgCl | AgI比AgCl的溶解度更小,更容易沉淀 |
| C | 将绿豆粒大小的钠加入到乙醇中,钠在液面上剧烈反应 | 钠的密度小于乙醇,钠能置换出醇羟基中的氢,生成了氢气 |
| D | 向盛有经打磨的铝片的试管中加入5mL 6mol?L-1盐酸,气泡生成速率先加快后减慢 | 反应放热致温度升高是速率先加快的主要原因;c(H+)降低是速度后减慢的主要原因 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
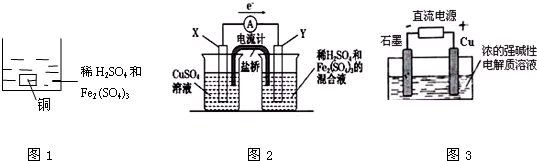
| A、如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L |
| B、如图2所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜 |
| C、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 |
| D、如图3所示,当有0.1mol电子转移时,有0.1mol Cu2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、目前治理白色污染的方法主要是减少使用、加强回收 |
| B、少量钠、钾要在干燥的试剂瓶中保存妥善保管 |
| C、废旧电池应集中回收进行填埋处理 |
| D、柠檬是酸性食物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com