
 如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )
如图所示,a、b、c、d均为石墨电极,通电一段时间后,各电极上的生成物的物质的量之比依次为4:1:2:2,则甲、乙两池中的电解质分别是( )
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
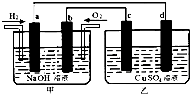 如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( )
如图所示,a、b、c、d为惰性电极.甲装置中a、b两个电极上分别通入H2、O2,电解质溶液为NaOH溶液,乙装置中电解质溶液为CuSO4溶液,下列有关说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com