
【题目】重要的化学品M和N的合成路线如图所示:

已知:i.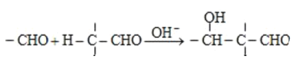
ii.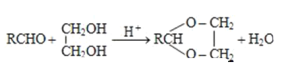
iiiN的结构简式是:
请回答下列问题:
(1)A中含氧官能团名称是______,C 与E生成M的反应类型是______.
(2)写出下列物质的结构简式:X:______ Z:______ E:______
(3)C和甲醇反应的产物可以发生聚合反应.该聚合反应的产物是:______.
(4)1mol G一定条件下,最多能与______mol H2发生反应
(5)写出一种符合下列要求G的同分异构体______
①有碳碳叄键 ②能发生银镜反应 ③一氯取代物只有2种
(6)1,3﹣丙二醇是重要的化工物质,请设计由乙醇合成它的流程图______,合成路线流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH.
CH3CH2OH.
【答案】羟基、醛基 酯化反应 ![]() CH2=CHCHO
CH2=CHCHO 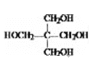
 3 CH3C≡CCH2CHO或CH3CH2C≡CCHO等
3 CH3C≡CCH2CHO或CH3CH2C≡CCHO等 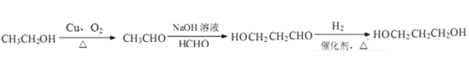
【解析】
有机物X与HCHO发生信息i的反应,结合A的分子式为C9H10O2可知,X为![]() ,A为
,A为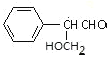 ,A发生消去反应脱去1分子H2O生成B,故B为
,A发生消去反应脱去1分子H2O生成B,故B为 ,B氧化生成C为
,B氧化生成C为 ;由信息iii中N的结构,结合信息ii中反应以及M的分子式C41H36O8可知,形成M的物质为
;由信息iii中N的结构,结合信息ii中反应以及M的分子式C41H36O8可知,形成M的物质为 、
、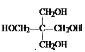 ,所以E为
,所以E为 ,C与E通过酯化反应生成M;由Y到E的转化,结合E的结构可知,Y不含苯环,再结合G的结构可知,化合物Z中含有苯环,结合反应信息i可知,Y为CH3CHO,由N的结构,结合信息ii中反应可知,E、G分别为CH2=CHCH=CHCHO、
,C与E通过酯化反应生成M;由Y到E的转化,结合E的结构可知,Y不含苯环,再结合G的结构可知,化合物Z中含有苯环,结合反应信息i可知,Y为CH3CHO,由N的结构,结合信息ii中反应可知,E、G分别为CH2=CHCH=CHCHO、 中的一种,由E的结构可知G为CH2=CHCH=CHCHO,比较G与Y的结构可知,Z为CH2=CHCHO,Y和Z发生加成反应得F为CH2=CHCH(OH)CH2CHO,F发生消去反应得G,Y与甲醛发生加成反应得D为(HOCH2)3CCHO,D与氢气发生加成反应得E,乙醇合成1,3﹣丙二醇,可以将乙醇氧化成乙醛,用乙醛再与甲醛发生加成后再还原即可得到1,3﹣丙二醇,据此答题。
中的一种,由E的结构可知G为CH2=CHCH=CHCHO,比较G与Y的结构可知,Z为CH2=CHCHO,Y和Z发生加成反应得F为CH2=CHCH(OH)CH2CHO,F发生消去反应得G,Y与甲醛发生加成反应得D为(HOCH2)3CCHO,D与氢气发生加成反应得E,乙醇合成1,3﹣丙二醇,可以将乙醇氧化成乙醛,用乙醛再与甲醛发生加成后再还原即可得到1,3﹣丙二醇,据此答题。
(1)由上述分析可知,A为 ,含有羟基、醛基,C与E通过酯化反应生成M;
,含有羟基、醛基,C与E通过酯化反应生成M;
(2)由上述分析可知,X的结构简式是![]() ,Z为 CH2=CHCHO,E为
,Z为 CH2=CHCHO,E为 ;
;
(3)C为 ;
; 和甲醇发生酯化反应得到的产物再发生加聚反应生成高聚物为
和甲醇发生酯化反应得到的产物再发生加聚反应生成高聚物为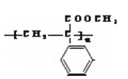 ;
;
(4)G为CH2=CHCH=CHCHO,1mol G一定条件下,最多能与3mol H2发生反应;
(5)G为CH2=CHCH=CHCHO,根据条件①有碳碳叄键,②能发生银镜反应,说明有醛基,③一氯取代物只有2种,则符合要求的G的一种同分异构体为CH3C≡CCH2CHO或CH3CH2C≡CCHO等;
(6)乙醇合成1,3﹣丙二醇,可以将乙醇氧化成乙醛,用乙醛再与甲醛发生加成后再还原即可得到1,3﹣丙二醇,合成路线为![]() 。
。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料。工业上提取铝的工艺流程如下:
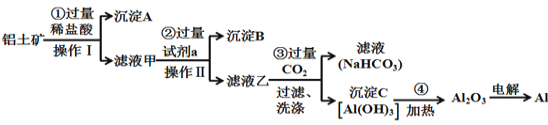
(1)在操作Ⅰ之前先将铝土矿研磨成粉末,目的是:___________________;
(2)沉淀A的化学式是__________;
(3)步骤③中通入过量CO2,产生沉淀C的离子方程式为_________________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为____________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是___________;
a. MgO b. V2O5 c. Fe3O4 d. MnO2
(6)我国首创以铝—空气—海水电池为能源的新型电池,用作海水标志灯已研制成功。该电池以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。负极材料是铝,正极材料可以用石墨。写出正极电极反应式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
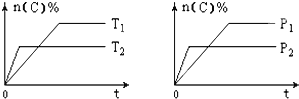
A. 根据图象无法确定改变温度后平衡移动方向
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a>c+d
D. 升高温度,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amol NaHCO3和bmol Na2O2固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,![]() 的值可能为
的值可能为
A.1.0B.1.35C.1.5D.2.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验一:碘含量的测定
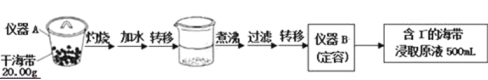
取0.0100mol/L的AgNO3标准溶液滴定100.00mL海带浸取原液,用电势滴定法测定碘的含量.测得的电动势(E)反映溶液中c(I﹣) 变化,用数字传感器绘制出滴定过程中曲线变化如图所示:

实验二:碘的制取
另取海带浸取原液,甲、乙两种实验方案如图所示:
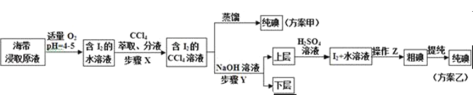
已知:3I2+6NaOH→5NaI+NaIO3+3H2O
请回答:
(1)实验一中的仪器名称:仪器A______,仪器B______;实验二中操作Z的名称______.
(2)根据表中曲线可知:此次滴定终点时用去AgNO3溶液的体积为______ml,计算该海带中碘的百分含量为______.
(3)步骤X中,萃取后分液漏斗内观察到的现象是______.
(4)下列有关步骤Y的说法,正确的是______
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
方案乙中,上层液体加硫酸发生反应的离子方程式是______.
(5)方案甲中采用蒸馏不合理,理由是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解滴有石蕊的饱和食盐水a,以下判断正确的是( )
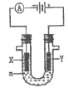
A.电解时化学能转变为电能
B.Y极附近最终变为红色
C.电子流向:X→负极→正极→Y
D.电解一段时间两极收集的气体体积:X极>Y极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中有广泛应用,其吸收处理也十分重要。
(1)完成并配平下列离子方程式_____。
Fe3++ SO2+ → Fe2++ SO42-+
(2)标明电子转移的方向和数目______: Fe3++ SO2……。
(3)在Na2SO3溶液中滴加酚酞,溶液呈红色,若在该溶液中滴入过量的BaCl2溶液,实验现象为:_____。请结合离子方程式,运用平衡原理进行解释_____。
(4)在NaClO溶液中通入SO2,写出反应的离子方程式:_____。
(5)在0.1mol/LNa2SO3溶液中,下列关系式正确的是_____。
a.[Na+]+[H+]=[SO32-]+[HSO3-]+[OH-] b.[Na+]>[SO32-]>[OH-]>[H+]
c.[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3] d.[Na+]=2[SO32-]>[OH-]=[H+]
(6)向该溶液中加入少量Na2SO3固体,![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是

A.原溶液中一定含有Na2SO4
B.反应最后形成的溶液中的溶质只有NaCl
C.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质 | 溶解度( g/100g水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 87 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com