
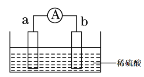
【题目】(1)如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则电子由_____(填“a”或“b”,下同) 极流向_____极,电解质溶液中![]() 移向_____极,a极上的电极反应式为___________________。
移向_____极,a极上的电极反应式为___________________。
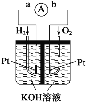
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为___________,若将燃料改为CH4,写出其负极反应方程式_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_________(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
【答案】b a b 2H+ + 2e- = H2↑ O2+2H2O+4e-=4OH- CH4+10OH--8e-=![]() +7H2O c 2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓ 0.448
+7H2O c 2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓ 0.448
【解析】
在铁、碳、稀硫酸形成的原电池中,气泡应在正极表面产生,由此确定a、b与正、负极的关系,从而得出电子流动的方向、电极反应式及离子迁移;在CH4碱性燃料电池中,通O2的电极为正极,通燃料的电极为负极,由于电解质呈碱性,所以CH4燃烧的最终生成物应为![]() ;青铜器在潮湿环境中发生的电化学反应中,依据电极产物,判断电子得失情况,从而确定正、负极;在利用腐蚀产物进行耗氧量计算时,需从电荷守恒角度分析产物与电子守恒的关系。
;青铜器在潮湿环境中发生的电化学反应中,依据电极产物,判断电子得失情况,从而确定正、负极;在利用腐蚀产物进行耗氧量计算时,需从电荷守恒角度分析产物与电子守恒的关系。
(1)a极上有大量气泡生成,则a极为正极(碳棒),b极为负极(铁片),电子由负极流向正极,即由b极流向a极,电解质溶液中,阴离子向负极移动,即![]() 移向b极,a极上的H+得电子生成H2,电极反应式为2H+ + 2e- = H2↑。答案为:b;a;b;2H+ + 2e- = H2↑;
移向b极,a极上的H+得电子生成H2,电极反应式为2H+ + 2e- = H2↑。答案为:b;a;b;2H+ + 2e- = H2↑;
(2)在氢氧燃料电池中,负极为Pt(通H2),正极为Pt(通O2),正极O2得电子产物与水反应生成OH-,正极反应方程式为O2+2H2O+4e-=4OH-,若将燃料改为CH4,则负极为通CH4的电极,CH4失电子产物与电解质反应生成![]() 和水,负极反应方程式为CH4+10OH--8e-=
和水,负极反应方程式为CH4+10OH--8e-=![]() +7H2O。答案为:O2+2H2O+4e-=4OH-;CH4+10OH--8e-=
+7H2O。答案为:O2+2H2O+4e-=4OH-;CH4+10OH--8e-=![]() +7H2O;
+7H2O;
(3)青铜器在潮湿环境中因发生电化学腐蚀,Cu失电子生成Cu2+,O2得电子产物与水反应生成OH-。
①腐蚀过程中,Cu作负极,负极是c;
②环境中的Cl- 扩散到孔口,并与正极反应产物OH-和负极反应产物Cu2+作用,生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓;
③Cu2(OH)3Cl的质量为4.29 g,物质的量为![]() =0.02mol,需消耗0.04molCu2+、0.06molOH-,电极反应式为Cu-2e-==Cu2+,O2+4e-+2H2O==4OH-,则线路中转移电子0.08mol,需消耗O20.02mol,则理论上耗氧体积为0.02mol×22.4L/mol=0.448L(标况)。
=0.02mol,需消耗0.04molCu2+、0.06molOH-,电极反应式为Cu-2e-==Cu2+,O2+4e-+2H2O==4OH-,则线路中转移电子0.08mol,需消耗O20.02mol,则理论上耗氧体积为0.02mol×22.4L/mol=0.448L(标况)。
答案为:c;2Cu2++3OH-+ Cl-==Cu2 (OH)3Cl↓;0.448。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和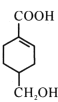 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。
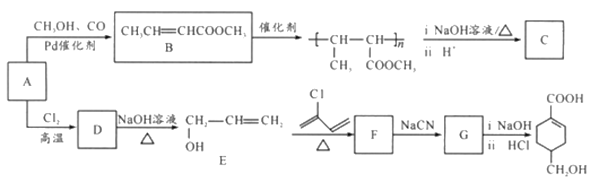
已知: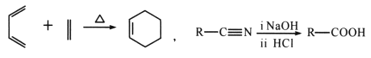
(1) 发生缩聚形成的高聚物的结构简式为__________;D-E的反应类型为__________。
发生缩聚形成的高聚物的结构简式为__________;D-E的反应类型为__________。
(2)E-F的化学方程式为____________________。
(3)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是________________(写出结构简式)。
(4)等物质的量的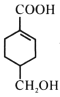 分别与足量NaOH、Na2CO3、NaHCO3反应, 消耗NaOH、Na2CO3 、NaHCO3的物质的量之比为________________;检验
分别与足量NaOH、Na2CO3、NaHCO3反应, 消耗NaOH、Na2CO3 、NaHCO3的物质的量之比为________________;检验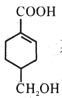 的碳碳双键的方法是________________(写出对应试剂及现象)。
的碳碳双键的方法是________________(写出对应试剂及现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有如图所示物质间的相互转化,已知A是一种金属单质。

试回答:
(1)写出下列物质的化学式B________,D________;
(2)写出由E转变成F的化学方程式________;
(3)写出下列反应的离子方程式:D溶液与AgNO3反应________;向G溶液加入A的有关离子反应方程式________;
(4)焰色反应是________变化(填“物理”或“化学”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
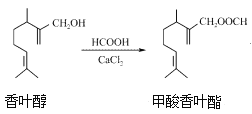
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 香叶醇与CH2=CHCH=CHCH2OH互为同系物
D. 香叶醇与甲酸香叶酯均不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是制造化肥的重要原料,如图为工业合成氨的流程图。下列有关说法错误的是
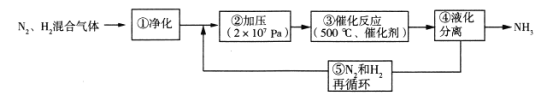
A.工业上制氮气一般用分离液态空气法
B.步骤②、③、④、⑤均有利于提高反应物的平衡转化率
C.步骤①中“净化”N2、H2混合气体可以防止催化剂中毒
D.步骤③中温度选择500℃,主要是考虑催化剂的活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在横线上。
同位素____;同一种物质___;同系物____;同分异构体____;同素异形体___。
①金刚石与石墨; ②D与T; ③12C和13C; ④O2与O3; ⑤CH4和CH3CH2CH3;⑥CH2=CHCH3和CH2=CH2;⑦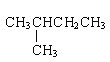 和CH3(CH2)3CH3 ⑧
和CH3(CH2)3CH3 ⑧ 和
和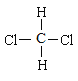
⑨三氯甲烷和氯仿 ⑩CH2=CHCH3和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向等体积(V0mL)等浓度(0.1 mol .L-1)的盐MCl、NaR、MR溶液中分别加入蒸馏水,使其稀释VmL,稀释过程中,溶液的pH与lg![]() 的关系如图所示。下列有关说法正确的是
的关系如图所示。下列有关说法正确的是
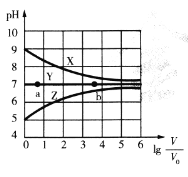
A.曲线X对应的盐为NaR,MCl为强酸强碱盐
B.对于曲线Y,a点水的电离程度比b点小
C.常温下,MOH的电离平衡常数Kb的数量级为10-3
D.曲线Z上任何一点对应溶液中均存在c(H+) =c(OH-) +c( MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol H2(g)中的H—H键需要吸收436.4 kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498 kJ的能量,生成H2O(g)中的1 mol H—O键能放出462.8 kJ的能量。下列说法正确的是( )
A. 断裂1 mol H2O中的化学键需要吸收925.6 kJ的能量
B. 2H2(g)+O2(g)===2H2O(g) ΔH=-480.4 kJ·mol-1
C. 2H2O(l)===2H2(g)+O2(g) ΔH=471.6 kJ·mol-1
D. H2(g)+![]() O2(g)===H2O(l) ΔH=-240.2 kJ·mol-1
O2(g)===H2O(l) ΔH=-240.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C、D和E;C又可以转化为B、A。它们的转化关系如下:
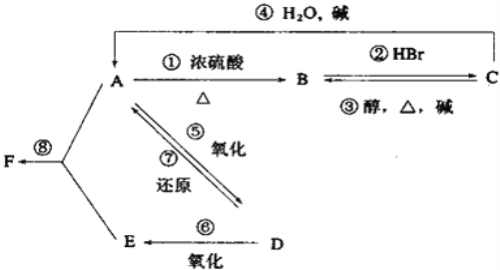
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应
(1)写出下列物质的结构简式。A__________B________D__________
(2)完成下列阶段变化的化学方程式。
①_________________________________
③_________________________________
⑦_________________________________
⑧_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com