
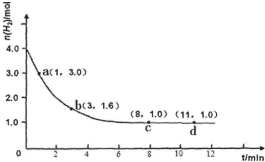
 ��ҵ�ϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0ijʵ�齫3.0mol N2��g����4.0mol H2��g�������ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯��ͼ��ʾ��
��ҵ�ϳɰ��ķ�ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0ijʵ�齫3.0mol N2��g����4.0mol H2��g�������ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯��ͼ��ʾ������ ��1������v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
��2������ƽ��ʱ�����ʵ�Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻
��3����ͼҪ�㣺��T1��T2�������¶ȣ���Ӧ���ʼ�С����λʱ�����������������ʵ�����С���ﵽƽ��ʱ��������������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ�����ƽ��ʱ���������ʵ�����С��
��4������Qc��K�ô�С��ϵ���жϷ�Ӧ�ķ���
��5���ټ�������2mol�����ų���������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
�ڷ�Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ�
��6��ԭ��ظ�������������Ӧ�������ڸ���ʧȥ���ӣ��������������ɵ�����ˮ��
��� �⣺��1����Ӧ��ʼ3min�ڣ����������ʵ���1.6mol����v��H2��=$\frac{4.0m-1.6mol}{10L��3min}$=0.080mol/��L•min����
�ʴ�Ϊ��0.080mol/��L•min����
��2����ͼ���֪��ƽ��ʱH2��Ũ��0.10 mol/L����
N2��g��+3H2��g��?2NH3��g��
��ʼŨ�ȣ�mol/L�� 0.30 0.40 0
ת��Ũ�ȣ�mol/L�� 0.10 0.30 0.20
ƽ��Ũ�ȣ�mol/L�� 0.20 0.10 0.20
K=$\frac{0��{2}^{2}}{0.2��0��{1}^{3}}$=2.0��102 ��L/mol��2��
�ʴ�Ϊ��2.0��102 ��L/mol��2��
��3��T1��T2�������¶ȣ���Ӧ���ʼ�С����λʱ�����������������ʵ�����С���ﵽƽ��ʱ��������������Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ�����ƽ��ʱ���������ʵ�����С����ͼ��Ϊ��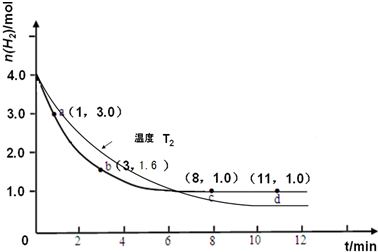 ��
��
�ʴ�Ϊ�� ��
��
��4����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦQc=$\frac{��\frac{2}{0.5}��^{2}}{\frac{2}{0.5}����\frac{1}{0.5}��^{3}}$=0.5=K������
ƽ�ⲻ�ƶ�����v��N2����=v��N2�������ʴ�Ϊ��=��
��5������2mol�����ų�������Ϊ46.1kJ��2=92.2kJ����Ӧ�Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��?2NH3��g����H=-92.2kJ/mol���ʴ�Ϊ��N2��g��+3H2��g��?2NH3��g����H=-92.2kJ/mol����Ͽ�1mol N-H�������������xkJ����945.8kJ/mol+3��436.0kJ/mol-6��xkJ/mol=-92.2kJ/mol�����x=391��
�ʴ�Ϊ��391��
��6��ԭ��ظ�������������Ӧ�������ڸ���ʧȥ���ӣ��������������ɵ�����ˮ�������缫��ӦʽΪ��2NH3+6OH--6e-=N2+6H2O��
�ʴ�Ϊ��2NH3+6OH--6e-=N2+6H2O��
���� ���⿼�黯ѧƽ�⡢���ʵļ��㡢��Ӧ�ȵļ��㣬��ȷ���η����㼰���ʵ���֮�ȵ������֮�ȵĹ�ϵ���ɽ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȣ�K�� CO2ת���ʣ�%�� n��H2��/n��CO2�� | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 | B�� | 2 | C�� | 6.02��1023 | D�� | 1.204��1024 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��/s | c��NO��/mol•L-1 | c��CO��/mol•L-1 |
| 0 | 1.00��10-3 | 3.60��10-3 |
| 1 | 4.50��10-4 | 3.05��10-3 |
| 2 | 2.50��10-4 | 2.85��10-3 |
| 3 | 1.50��10-4 | 2.75��10-3 |
| 4 | 1.00��10-4 | 2.70��10-3 |
| 5 | 1.00��10-4 | 2.70��10-3 |
| ��ѧʽ | ���볣�� |
| H2SO3 | K1=1.3��10-2��K2=6.2��10-8 |
| H2CO3 | K1=4.3��10-7��K2=5.6��1011 |
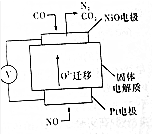
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
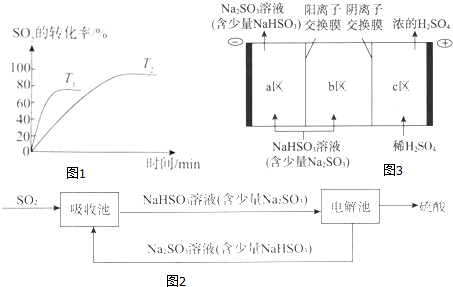
| Ͷ�ϱ� | a | b | c | d |
| SO2ƽ��ת����/% | 97.1 | 96.8 | 95.8 | 90.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 2010�����˻����ҹ����ݳɹ��ٰ죬�������˻������˻������
2010�����˻����ҹ����ݳɹ��ٰ죬�������˻������˻�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | p ��Ne����p ��H2����p ��O2�� | B�� | p ��O2����p ��Ne����p ��H2�� | C�� | p ��H2����p ��O2����p ��Ne�� | D�� | p ��H2����p ��Ne����p ��O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�ȩ������Br2�����ӳɷ�Ӧ | |
| B�� | �Ȼ�ȩ�ܷ���������Ӧ | |
| C�� | 1 mol�Ȼ�ȩ��������2 mol H2�����ӳɷ�Ӧ | |
| D�� | �Ȼ�ȩ����ϩ��ͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com