
已知葡萄糖在乳酸菌的催化作用下可转化为乳酸(C3H6O3).
(1)取9.0g乳酸与足量金属钠反应,可产生2.24L气体(标准状况).另取9.0g乳酸与相同物质的量的乙醇反应,生成0.1mol乳酸乙酯和1.8g H2O.由此推断乳酸分子中含有的官能团的名称及数目 , .
(2)乳酸在铜作催化剂时,可氧化成丙酮酸(CH3COCOOH),乳酸分子在一定条件下可发生缩聚反应生成一种高分子化合物,此高分子化合物的结构简式为 .
考点: 有机物分子中的官能团及其结构.
专题: 有机物的化学性质及推断.
分析: (1)9.0g乳酸的物质的量=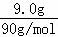 =0.1mol,氢气的物质的量=
=0.1mol,氢气的物质的量=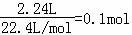 ,0.1mol乳酸与足量金属钠反应,可产生0.1mol气体(标准状况),能和钠反应的官能团有羟基和羧基;
,0.1mol乳酸与足量金属钠反应,可产生0.1mol气体(标准状况),能和钠反应的官能团有羟基和羧基;
能和醇反应的官能团是羧基,0.1mol乳酸与相同物质的量的乙醇反应,生成0.1mol乳酸乙酯和1.8g H2O,说明一个弱酸分子中含有一个羧基,则乳酸分子中另一个官能团是醇羟基;
(2)乳酸在铜作催化剂时,可氧化成丙酮酸(CH3COCOOH),说明醇羟基位于中间碳原子上,乳酸分子在一定条件下可发生酯化反应的缩聚反应,据此写出反应方程式.
解答: 解:(1)9.0g乳酸的物质的量=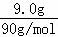 =0.1mol,氢气的物质的量=
=0.1mol,氢气的物质的量=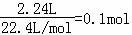 ,0.1mol乳酸与足量金属钠反应,可产生0.1mol气体(标准状况),说明乳酸中有两个官能团和钠反应;
,0.1mol乳酸与足量金属钠反应,可产生0.1mol气体(标准状况),说明乳酸中有两个官能团和钠反应;
0.1mol乳酸与相同物质的量的乙醇反应,生成0.1mol乳酸乙酯和1.8g H2O,说明一个弱酸分子中含有一个羧基,则乳酸分子中另一个官能团是醇羟基,
故答案为:羧基一个,醇羟基一个;
(2)乳酸在铜作催化剂时,可氧化成丙酮酸(CH3COCOOH),说明醇羟基位于中间碳原子上,乳酸中含有醇羟基和羧基,所以在一定条件下,乳酸能发生缩聚反应生成高聚物,反应方程式为: ,
,
故答案为: .
.
点评: 本题考查有机物的结构和性质,明确物质的官能团及其性质是解本题关键,难度不大.


科目:高中化学 来源: 题型:
用一种试剂就能鉴别乙醇、乙酸、乙醛、甲酸四种物质.该试剂可以是下列中的( )
A. 银氨溶液 B. 溴水
C. 碳酸钠溶液 D. 新制氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
现有乙二醇(C2H6O2)与醋酸(CH3COOH)组成的混合物,测得其中氢元素的质量分数为9%,则混合物中氧元素的质量分数为( )
A. 52% B. 37% C. 16% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
将过量铁粉放入硝酸锌和硝酸银的混合溶液中,充分反应后过滤,滤液中的金属离子是( )
A. Fe2+ B. Fe2+、Zn2+ C. Fe2+、Ag+ D. Fe2+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42﹣、NO3﹣、Cl﹣中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).下列说法不正确的是( )
A. 若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
B. 若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C. 该溶液中所含的离子是:Fe2+、Na+、SO42﹣、NO3﹣
D. 若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:
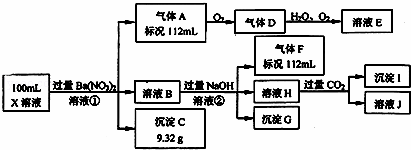
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是
用离子方程表达下列反应:
①中生成气体A: .
②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl﹣)为 mol/L.(若有些离子不存在,请填0mol/L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com