
A、HClO的电子式: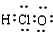 | ||
B、CH4分子的球棍模型: | ||
C、硝基苯的结构简式: | ||
D、中子数为10的氧原子:
|
 为甲烷的比例模型,甲烷的球棍模型需要用短棍和大小不同的小球表示;
为甲烷的比例模型,甲烷的球棍模型需要用短棍和大小不同的小球表示; ,故A错误;
,故A错误; ,故B错误;
,故B错误; ,故C错误;
,故C错误;18 8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
| A、2H2(g)+O2(g)=2H2O(g)△H=-571.6 kJ/mol |
| B、C-H键键长小于H-H键 |
| C、C≡C键能为796.0 kJ/mol |
| D、2CH4(g)=C2H2(g)+3H2(g)△H=-376.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫代硫酸钠与稀硫酸 |
| B、硫与热NaOH溶液 |
| C、H2O2溶液中加入MnO2 |
| D、KClO3与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钯催化剂能提高碳原子反应的活性 |
| B、钯催化剂能催化所有类型的有机反应 |
| C、“钯催化交叉偶联反应”有利于人类合成复杂分子 |
| D、利用该技术能改变合成路径,降低反应发生的条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量SO2气体通入氨水中:SO2+2NH3?H2O=2 NH4++SO32-+H2O |
| B、向FeI2溶液中通入足量的氯气:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| C、向氢氧化钡溶液中逐滴加入少量碳酸氢钠溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| D、硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、K+、Fe+、NO3- |
| B、OH-、Cl-、Na+、NH4+ |
| C、Mg2+、K+、Cl-、NO3- |
| D、Cu2+、NO3-、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
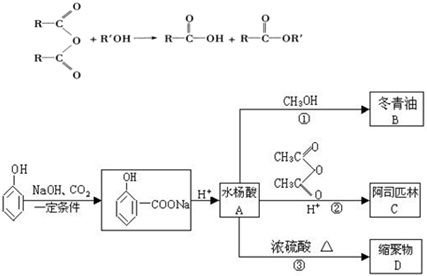
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com