


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、同周期元素中,ⅦA族元素的原子半径最大 |
| B、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C、室温时,零族元素的单质都是气体 |
| D、所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
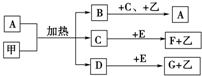 已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.
已知化合物A、B、C、D、E、F、G和单质甲、乙所含元素均为短周期元素,A的浓溶液与甲能发生如图所示的反应,甲是常见的固体单质,乙是常见的气体单质,B是无色气体,是主要的大气污染物之一,请根据图示回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
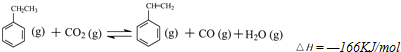
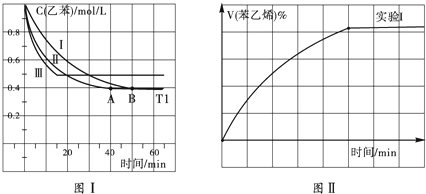
查看答案和解析>>
科目:高中化学 来源: 题型:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
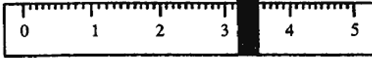
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 操作 |
| (1)SiO2(CaCO3) | ||
| (2)SiO2(Si) | ||
| (3)NaCl(SiO2) | ||
| (4)SiO2(H2SiO3) | ||
| (5)Fe2O3(SiO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
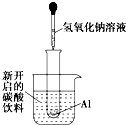 如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块铝片,再用滴管滴加5mL浓NaOH溶液于试管中,试回答下列问题:
如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块铝片,再用滴管滴加5mL浓NaOH溶液于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T/℃ | NO初始浓度 mol?L-1 | CO初始浓度 mol?L-1 | 催化剂的比表面积 ㎡?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 124 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com