
����Ŀ������Һ��Cl2����������������Cl2+SO2+2H2O��2HCl+H2SO4����ͼ���йض����������ʵ�ʵ��װ��ͼ���Իش�����������
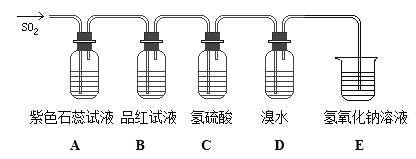
��1��A��B��C��D�ĸ�װ���з���������������________________��________________��_________________��__________________��
��2������������У���Ư���� ����������������� �ۻ�ԭ�� �������ԡ�����ͼ����װ���ж�Ӧ���ֳ��������ǣ�����ţ�
A��_______________B��______________C��________________D��________________��
��3��ʵ����ϣ���B����Һȡ�������Թ��У����ȣ�������_______________��ԭ���ǣ�________________________________��
��4��ʵ����ϣ�ȡ����D����Һ���Թ��У�����BaCl2��Һ��ϡ���ᣬ�����ǣ�_______________________________________________��
��5��E�з�����Ӧ�Ļ�ѧ����ʽΪ____________________________________________��
��6������һ����ʵ֤��Cl�ķǽ����Ա�Sǿ___________________________________��
���𰸡� A����ɫʯ����ɫ B��Ʒ����ɫ C�в�������ɫ����/���� D����ˮ��ɫ �� �� �� �� ��Һ�ָ���ɫ SO2Ư���Ծ����Ȳ��ȶ��� ������ɫ���� 2NaOH+SO2=Na2SO3+H2O ��H2S+ Cl2= 2HCl+ S �����ֱ��������
�������� (1) SO2+H2O![]() H2SO3,ʯ����������SO2�� Ư �� ����Ʒ �� �� ɫ��2H2S+SO2=3S��+2
H2SO3,ʯ����������SO2�� Ư �� ����Ʒ �� �� ɫ��2H2S+SO2=3S��+2
H2O���� ɫ �� ����Br2+2H2O+SO2=2HBr+H2SO4���� ˮ �� ɫ����ȷ��Ϊ��A����ɫʯ����ɫ��B��Ʒ����ɫ��C�в�������ɫ����/������D����ˮ��ɫ��
��2��A�б���SO2��������������ʣ�B�б���SO2Ư���ԣ�C�б���SO2�����ԣ�D�б���SO2�� ��ԭ�ԣ���ȷ��Ϊ���ڣ��٣��ܣ��ۣ�
��3��SO2���� �� ɫ �� ��ϳɲ��ȶ�����ɫ������������ɫ�����Ⱥ������ȶ�����ɫ�����зֽ��ͷų�SO2�����ʻָ�Ϊԭ������ɫ����ȷ��Ϊ����Һ�ָ���ɫ��SO2Ư���Ծ����Ȳ��ȶ��ԣ�
��4��Br2+2H2O+SO2=2HBr+H2SO4����Һ�к���SO42-����Ba2+�� �� �� �� ɫ �� ��Ba SO4����ȷ�𰸣�������ɫ������
��5������ �� �� �� �� �� �� SO2��Ӧ �� �� �� �� �� �κ�ˮ����ȷ�𰸣�2NaOH+SO2=Na2SO3+H2O
��6���� �� ���� �������� ������ ��֤ �� �������� ȷ �� ����������ͨ�뵽��������Һ������Һ���ɫ������
���÷���ʽ��ʾΪH2S+ Cl2= 2HCl+ S��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��зḻ�ĺ�ˮ��Դ�����������ú�ˮ��Դ�ǵ�ǰ��ѧ�о���һ����Ҫ������ͼ�Ǻ�ˮ�ۺ����õ�һ�����档
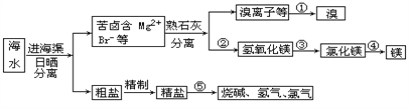
��ش��������⣺
��1��������Ҫ��Ӧ�ĵ����ӷ���ʽ��_____________________________________________��
��2�������������þ�IJ���Ϊ________________________________��
��������Ҫ����________________________________________��
��3������ʳ���к��е�Mg2+��Ca2+��SO42�������ʳ�ȥ��������Լ���(������˳������_________________(ֻҪ����һ������Ĵ𰸼���) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼�Ļ��������γ���ǧ���ֻ���������е�����֮���������ת������ش��������⣺
��1���л���M���й��ʱ�������ת����N���������ͼ�� 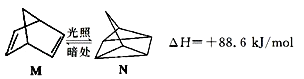
���н��ȶ���������M��ԭ���� ��
��2����֪ ![]() ��l����ȼ����Ϊ3267.5kJmol��1 ��
��l����ȼ����Ϊ3267.5kJmol��1 �� ![]() ��l��+6O2��g���T6CO2��g��+3H2��g��
��l��+6O2��g���T6CO2��g��+3H2��g��
��H=a kJmol��1 �� ��a��3267.5�����������������=������
��3��ʹBr2��g����H2O��g����1500��ʱ�뽹̿��Ӧ������HBr��CO2 �� ����1mol Br2��g�����뷴Ӧʱ�ͷų�125kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��4����C��ʯī����Al�ۺ�TiO2������һ�������������£��ڼ��ߵ��¶������գ��������ʿ������²��ϣ�4Al��s��+3TiO2��s��+3C��s���T2Al2O3��s��+3TiC��s����H=��1440kJmol��1 �� ��Ӧ�����У�ÿת��amol���ӷų�������Ϊ���ú�a�ı���ʽ��ʾ����
��5����֪��Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H=+490.0kJmol��1
CO��g��+ ![]() O2��g��=CO2��g����H=��280.0kJmol��1
O2��g��=CO2��g����H=��280.0kJmol��1
C��ʯī��+O2��g��=CO2��g����H=��390.5kJmol��1
2Fe2O3��s��=4Fe��s��+3O2��g����H= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A.��Ҫ���ȵĻ�ѧ��Ӧ�������ȷ�Ӧ
B.ԭ����ǽ�����ת��Ϊ��ѧ�ܵ�һ��װ��
C.���ʵ�ȼ�ն��Ƿ��ȷ�Ӧ
D.��ѧ�����γ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨij�����Ũ�ȣ���0.2molL��1��̼���Ʊ�Һ�������з�Ӧ��Ϊ����480mL�ı�Һ��ijͬѧ���������в�����������
��1����ҡ�Ⱥ���������ˮ���̶���1cm�������ý�ͷ�ιܼ�ˮ�� ֹ��Ȼ�����ƿ����������ָ�����Լ�ƿ�ڣ�
�����ձ���ע��Լ100mLˮ���ڽ����ºܿ��ܽ��꣮
��������ˮϴ�����ձ�3�Σ���ϴ��Һע���˷�Һ���ڣ�
�ܽ����º����Һ�ز�����ע�� �У� ������ƽ���� ��̼���Ʒ�ĩ������250mL���ձ��У�
��2����ͬѧ������ȷ��˳���� �����ţ�
��3����ͬѧ�IJ������������Ǵ��ģ����ţ�������������Һ��Ũ�� 0.2molL��1 �� ����=������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�������������ת����ϵ��ͼ��ʾ����Ӧ������ȥ����ͷ��ʾһ��ת���������и������У���������ͼת����ϵ���ǣ� ��
�� | �� | �� | �� | |
�� | SiO2 | NaOH | Na2SiO3 | CO2 |
�� | Fe | H2O | Fe2O3 | H2 |
�� | Al��OH��3 | NaOH��Һ | NaAlO2��Һ | ����CO2 |
�� | Na2O2 | CO2 | O2 | Na |
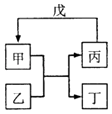
A.�٢�
B.�٢�
C.�ڢ�
D.�٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ�� ��ʯ���� ��ʯ���������ѻ������ı仯�����У����ƻ��������������ǣ���
A.���»��������»��������»���B.���ۼ������ۼ������ۼ�
C.���»��������ۼ������ۼ�D.���»��������»��������ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA+B��C�������� �У���A+B��X����X��C����Ӧ�����������仯��ͼ��ʾ��E1��ʾ��ӦA+B��X�Ļ�ܣ������� ��������ȷ���ǣ� �� 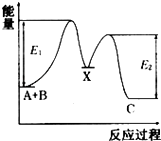
A.E2��ʾ��ӦX��C�Ļ��
B.X�Ƿ�ӦAʮB��C�Ĵ���
C.��ӦAʮB��C�ġ�H��0
D.��������ɸı䷴ӦAʮB��C���ʱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ����������������й㷺���ڣ�
��1������������ˮ�е�NH4+ �� ������ͼ1�� 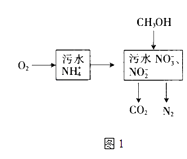
�ٸ��ݽ��µ��о���������ֻ��NO2������ˮ�뺬NH4+����ˮ��������ϣ�ֱ��ת��Ϊ�����壬������Ϊ ��
�ڿ�����NH4+ת��ΪNO3����NO2�� �� ��ҺpH�����������С�����䡱����
����ȫ������1mol NH4+��ˮ����n��O2����n��CH3OH����ϵʽΪ[��n��O2����n��CH3OH����ʾ]��
��2���ý�̿��ԭNO2�ķ�ӦΪ��2NO2��g��+2C��s ��N2��g��+2CO2��g�����ں��������£�1mol NO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ2��ʾ�� 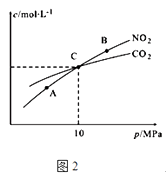
��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc��A��Kc��B�� �����������������������
��A��B��C������NO2��ת������ߵ������A����B����C�����㣮
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp��C��=��Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com