
【题目】在室温下,同种规格的铝片分别与下列物质混合,化学反应速率最大的是( )
A.0.1mol/L的盐酸15mL
B.0.2mol/L的盐酸12mL
C.0.25mol/L的盐酸8mL
D.18mol/L的硫酸15mL
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】碳及其化合物在有机合成、能源开发等工农业方面具有十分广泛的应用。
I.工业生产精细化工产品乙二醛(OHC-CHO)
(1)乙醇(CH3CH2OH)液相硝酸氧化法:在Cu(NO3)2催化下,用稀硝酸氧化乙醇制取乙二醛,此反应的化学方程式为_______________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点____________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
已知:2H2(g)+O2(g) ![]() 2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
2H2O(g)ΔH=-484kJ/mol,化学平衡常数为K1
OHC-CHO(g)+2H2(g) ![]() HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
HOCH2CH2OH(g) ΔH=-78kJ/mol,化学平衡常数为K2
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的ΔH=______;相同温度下,该反应的化学平衡常数K=______(用含K1、K2的代数式表示)。
Ⅱ.CO2的综合利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。

a.反应达平衡状态时,混合气体的平均相对分子质量保持不变
b.A点的正反应速率比B点正反应速率小
C.550℃时,若充入氦气,则V正、V逆均减小,平衡不移动
d.T℃时,反应达平衡后CO2的转化率为66.7%
e. T℃时,若再充入1molCO2和1molCO,平衡不移动
(4)氨气、CO2在一定条件下可合成尿素,其反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则
CO(NH2)2(s)+H2O(g),右图表示合成塔中氨碳比a与CO2转化率ω的关系。a为{n(NH3)/n(CO2)},b为水碳比{n(H2O)/n(CO2)}。则

①b应控制在______
a.1.5-1.6b.1-1.1c.0.6-0.7
②a应控制在4.0的理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 + 8H2SO4= 3CO2 + 2K2SO4+ 2Cr2(SO4)3 + 8H2O
①请用双线桥法标出电子转移方向和数目__________________________________
②上述反应中氧化剂是___________________(填化学式)。
(2)按如图所示操作,充分反应后:
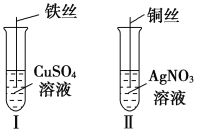
①Ⅰ中发生反应的离子方程式为_________________________________________
②结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________;
(2)化合物I的化学式为________;
(3)反应①的化学方程式为_____________;反应②的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H10O3的有机物,一定条件下具有如下性质:
①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应②在浓硫酸存在下,能脱水生成两种结构不同的能使溴水褪色的物质③在浓硫酸存在下,能生成一种分子式为C5H8O2的五元环状化合物,则C5H10O3的结构简式为( )
(已知:![]() )
)
A. HOCH2COOCH2CH2CH3 B. CH3CH(OH)CH2CH2COOH
C. CH3CH(OH)CH(CH3)COOH D. HOCH2CH2CHCH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂排出的废液主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:
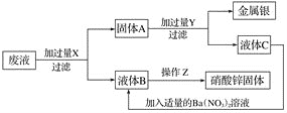
(1)X是____________,Y是____________ (写化学式,下同)。
(2)固体A、滤液B、C的主要成分:A______________,B______________,C______________。
(3)Z处进行的操作是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对某葡萄酒中SO2的含量进行检测,按下图连接好仪器。回答下列问题:

Ⅰ.样品蒸馏
取20.00mL样品和250 mL水置于仪器A中,仪器B是去掉塞子的碘量瓶,向其中装人25mL 乙酸铅溶液,然后向仪器A中加入10 mL盐酸,立即盖塞蒸馏;当碘量瓶中的液体约200 mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm 处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中的导管,并将冲洗液并入碘量瓶中。同时做空白实验(即不加样品情况下按同法操作,防止实验误差)。
已知:SO2+H2O+Pb(CH3COO)2=PbSO3↓+2CH3COOH。
(1)仪器A 的名称是_________________ 。
(2)实验中使用的碘量瓶最适宜的规格是_________ (填标号)。
a.100 mL b.250 mL c.500 mL d.1000 mL
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会导致测定结果__________(填“偏高”“ 偏低”或“不影响”)。
Ⅱ.滴定操作
向取下的碘量瓶中加入10 mL盐酸和1mL淀粉溶液,摇匀后用0.01mol·L-1的碘标准溶液滴定,记录消耗的碘标准溶液的体积为V( 单位为mL)。
(4)滴定终点的现象是_____________________,该滴定反应的离子方程式是______________。
Ⅲ.结果分析
(5)甲组4 次实验测得V分别为
实验 | 1 | 2 | 3 | 4 |
V/mL | 9.98 | 12.00 | 10.02 | 10.00 |
据此可计算此葡萄酒中SO2的含量为_______mg·L-1
乙组认为甲组实验不严谨,可能会有误差,因为甲组未做_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是( )
A.Fe2+、Fe3+
B.Fe2+、Cu2+
C.Fe3+、Cu2+
D.Cu+、Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com